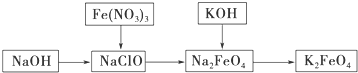
题目内容
15.按如图1所示装置进行铁和水蒸气反应的实验.(1)铁粉与水蒸气反应的化学方程式是:Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a-fgbch,描述能验证气体产物的实验现象黑色的氧化铜变成红色,白色的无水硫酸铜变成蓝色;

(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应,过滤.简述检验所得滤液中Fe3+的操作方法:取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁.原因是(用离子方程式说明):如果反应后的混合物中含有过量的铁粉,会发生反应2Fe3++Fe=3Fe2+,铁粉把铁离子全部还原为亚铁离子后滴入KSCN溶液不变红色;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色变为红褐色的化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如图2所示的装置:通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号).
A.电源中的a为正极,b为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-═H2↑

分析 (1)在高温下,铁粉和水蒸气反应,产物有四氧化三铁和氢气;
(2)生成的气体产物为氢气,氢气与氧化铜反应生成水,氢气与氧化铜反应之前要干燥,据此检验即可;
(3)检验滤液中是否含有Fe3+的简单方法是滴入几滴KSCN溶液,观察溶液是否变红色;
(4)反应生成四氧化三铁可以与稀硫酸发生反应Fe3O4+8H+=Fe2++2Fe3++4H2O,若铁粉过量,还可以和铁离子反应生成亚铁离子,所以滤液中可能含有铁离子,也可能不含有铁离子;
(5)①氢氧化亚铁不稳定接触空气时很快被氧化为氢氧化铁;
②要较长时间观察到氢氧化亚铁的白色沉淀,关键是怎样降低反应体系中氧气的量,利用生成的氢气赶净装置中的氧气,氢气应在下面的电极产生,据此答题;
解答 解:(1)在高温下,铁粉和水蒸气反应,产物有四氧化三铁和氢气,反应的化学方程式为:Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
故答案为:Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(2)将产生的气体干燥后再与氧化铜反应生成铜单质和水,无水硫酸铜遇水变蓝色,所以实验装置连接顺序为afgbch,能验证气体为氢气的实验现象是黑色的氧化铜变成红色,白色的无水硫酸铜变成蓝色,
故答案为:fgbch;黑色的氧化铜变成红色,白色的无水硫酸铜变成蓝色;
(3)检验滤液中是否含有Fe3+的简单方法是滴入几滴KSCN溶液,观察溶液是否变红色,若溶液变红色证明含有Fe3+,否则不含;
故答案为:取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子;
(4)反应生成四氧化三铁可以与稀硫酸发生反应Fe3O4+8H+=Fe2++2Fe3++4H2O,若铁粉过量,还可以和铁离子反应生成亚铁离子,所以滤液中可能含有铁离子,也可能不含有铁离子;
故答案为:如果反应后的混合物中含有过量的铁粉,会发生反应2Fe3++Fe=3Fe2+,铁粉把铁离子全部还原为亚铁离子后滴入KSCN溶液不变红色;
(5)①氢氧化亚铁不稳定接触空气时很快被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②要较长时间观察到氢氧化亚铁的白色沉淀,关键是怎样降低反应体系中氧气的量,利用生成的氢气赶净装置中的氧气,氢气应在下面的电极产生,
A.产生氢气的电极应为阴极,所以根据装置图可知,电源中的a为正极,b为负极,故A正确;
B.可以用NaCl溶液作为电解液,阴极产生氢氧化钠与阳极产生的亚铁离子生成氢氧化亚铁,故B正确;
C.阳极用铁作电极,阴极不一定要用铁作电极,故C错误;
D.阴极是氢离子得电子生成氢气,电极反应式是2H++2e-═H2↑,故D正确,
故选:ABD.
点评 本题考查了铁及其化合物性质的分析应用,实验过程分析和实验设计是解题关键,题目难度中等,知道水能使无水硫酸铜变蓝是水的特征反应,注意铁和水蒸气反应生成四氧化三铁而不是氧化铁,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用干燥的pH试纸检验CO2 | |
| B. | 用干燥的红色石蕊试纸检验NH3 | |
| C. | SO2能使湿润的品红试纸褪色 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 |
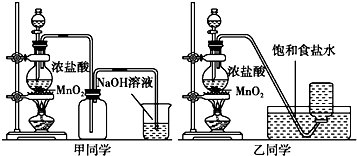
请回答:
(1)写出实验室制备氯气的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)对于乙同学的实验装置,若要停止实验,其操作顺序是②③①.
①停止加热 ②取出集气瓶盖好 ③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验.实验操作、现象、结论记录如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
A.CaC12和次氯酸B.浓盐酸NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四种试剂中D组试剂符合实际,且Cl的原子利用率最高.试写出这个反应的化学方程式NaCl+NaClO+H2SO4═Na2SO4+H2O+Cl2↑(产物中Na2SO4也可写成NaHSO4).
| A. | 烧结粘土制陶瓷 | B. | 湿法炼铜 | C. | 海水晒盐 | D. | 粮食酿酒 |
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因:K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
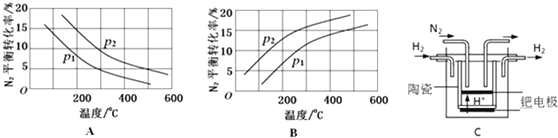
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是р2>р1.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(H2C2O4)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)=0.04mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |