题目内容
8.在一定温度下,某可逆反应aA(s)+bB(g)?cC(g)在一密闭的容器中达到平衡,如果t0时,改变某一外界条件,化学反应速率(v)-时间(t)图象如图所示.下列说法正确的是( )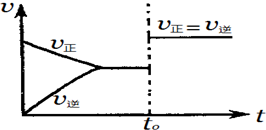
| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |
分析 由图可知,可逆反应到达平衡后,在t0时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动,据此结合选项解答.
解答 解:根据图象可知,条件改变后,正逆反应速率同时增大,且增大的程度相同,即平衡不移动,这说明改变的条件是催化剂或压强.但如果是改变压强,则说明反应前后气体的体积是不变的,即b=c.
A、b=c时,t0时可能是增大反应体系的压强,故A错误;
B、a、b、c是任何系数,都有可能是加入催化剂,故B错误;
C、由于a、b、c是任何系数,都有可能是加入催化剂,故C错误;
D、若a+b≠c,但是满足b=c,则t0时有可能是增大反应体系的压强,故D正确.
故选D.
点评 本题考查在气体体积不变的反应中,压强对反应速率的影响以及催化剂对化学反应速率的影响的知识,难度中等.

练习册系列答案
相关题目
7.X、Y、Z为短周期主族元素,X的最外层电子数为内层电子数的2倍,Y的最高化合价与最低化合价的代数和为4,Z与Y同周期,Z的原子半径小于Y.下列叙述不正确的是( )
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
13.下列物质中不能与氯水反应的是( )
| A. | AgNO3 | B. | NaHCO3 | C. | FeCl3 | D. | NaOH |
17.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图示.已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
18.在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( )
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、HSO32- |
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题: