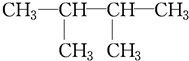题目内容
I、(1)已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
①利用上述反应检验食盐中是否加碘,所需试剂是 (填下列选项的序号)
A、碘水 B、KI溶液 C、淀粉溶液 D、稀硫酸 E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为 .
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为 L.
II、用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol?L-1稀硫酸,
实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④检漏、转移、洗涤 ⑤定容、摇匀
若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为 mL.
(2)实验时选用的仪器有(填序号) ,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面 ②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④.所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
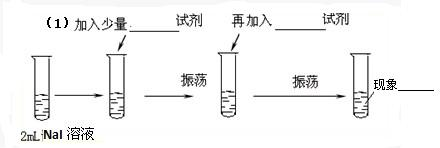
(4)检验试剂瓶中的溶液含有SO42- 的操作是 .
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
①利用上述反应检验食盐中是否加碘,所需试剂是
A、碘水 B、KI溶液 C、淀粉溶液 D、稀硫酸 E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为
II、用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol?L-1稀硫酸,
实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④检漏、转移、洗涤 ⑤定容、摇匀
若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面 ②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④.所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
(4)检验试剂瓶中的溶液含有SO42- 的操作是
考点:配制一定物质的量浓度的溶液,氯、溴、碘及其化合物的综合应用
专题:实验题,卤族元素
分析:Ⅰ(1)①根据题干反应方程式及检验碘单质的方法判断;
②先判断化合价变化,然后根据氧化还原反应中电子守恒计算出生成碘单质的物质的量;
(2)根据电子守恒计算出被氧化的氨气的物质的量及标况下的体积;
Ⅱ(1)先计算出浓硫酸的物质的量浓度,然后根据c1V1=c2V2计算出需要浓硫酸的体积;
(2)根据配制一定物质的量浓度的步骤选用仪器;
(3)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(4)检验硫酸根离子时,需要加入盐酸排除银离子的干扰,然后再加入氯化钡溶液,据此进行解答.
②先判断化合价变化,然后根据氧化还原反应中电子守恒计算出生成碘单质的物质的量;
(2)根据电子守恒计算出被氧化的氨气的物质的量及标况下的体积;
Ⅱ(1)先计算出浓硫酸的物质的量浓度,然后根据c1V1=c2V2计算出需要浓硫酸的体积;
(2)根据配制一定物质的量浓度的步骤选用仪器;
(3)根据c=
| n |
| V |
(4)检验硫酸根离子时,需要加入盐酸排除银离子的干扰,然后再加入氯化钡溶液,据此进行解答.
解答:
解:I、(1)①根据反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知,检验碘酸钾需要碘化钾、稀硫酸,还需要淀粉检验生成的碘单质,所以BCD正确,
故答案为:BCD;
②根据反应方程式可知,生成3mol碘单质,转移了5mol电子,如果反应中转移0.2mol电子,则生成I2的物质的量为:
×3=0.12mol,
故答案为:0.12mol;
(2)反应3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)中,8mol氨气参加反应,需要消耗3mol氯气,只有2mol氨气被氧化,若反应中消耗Cl21.5mol,则被氧化的氨气的物质的量为:
×2mol=1mol,1molNH3在标准状况下的体积约为22.4L,
故答案为:22.4;
II、(1)98%的浓硫酸(其密度为1.84g/cm3)的物质的量浓度为:
=
mol/L=18.4mol/L,配制100mL 1.0mol?L-1稀硫酸,需要该浓硫酸的体积为:
≈0.0054L=5.4mL,
故答案为:5.4;
(2)根据配制100mL 1.0mol?L-1稀硫酸的步骤可知,配制过程中需要的仪器为:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,所以需要使用的仪器为:CEFGH,
故答案为:CEFGH;
(3)①定容时俯视刻度线观察液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,故①正确,
②容量瓶使用时未干燥,对溶质的物质的量及溶液的最终体积没有影响,不影响配制结果,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故③错误;
④.所用的浓硫酸长时间放置在密封不好的容器中,导致浓硫酸浓度减小,量取的浓硫酸中含有的硫酸的物质的量偏小,配制的溶液浓度偏低,故④错误;
⑤用量筒量取浓硫酸时仰视读数,导致量取的浓硫酸体积偏大,配制的溶液中溶质的物质的量偏大,溶液的浓度偏高,故⑤正确;
故答案为:①⑤;
(4)检验硫酸根离子时,需要使用氯化钡溶液,所以应该先加入盐酸,排除氯化银的干扰,正确的检验方法为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-,
故答案为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-.
故答案为:BCD;
②根据反应方程式可知,生成3mol碘单质,转移了5mol电子,如果反应中转移0.2mol电子,则生成I2的物质的量为:
| 0.2mol |
| 5mol |
故答案为:0.12mol;
(2)反应3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)中,8mol氨气参加反应,需要消耗3mol氯气,只有2mol氨气被氧化,若反应中消耗Cl21.5mol,则被氧化的氨气的物质的量为:
| 1.5mol |
| 3mol |
故答案为:22.4;
II、(1)98%的浓硫酸(其密度为1.84g/cm3)的物质的量浓度为:
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 1.0mol/L×0.1L |
| 18.4mol/L |
故答案为:5.4;
(2)根据配制100mL 1.0mol?L-1稀硫酸的步骤可知,配制过程中需要的仪器为:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,所以需要使用的仪器为:CEFGH,
故答案为:CEFGH;
(3)①定容时俯视刻度线观察液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,故①正确,
②容量瓶使用时未干燥,对溶质的物质的量及溶液的最终体积没有影响,不影响配制结果,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故③错误;
④.所用的浓硫酸长时间放置在密封不好的容器中,导致浓硫酸浓度减小,量取的浓硫酸中含有的硫酸的物质的量偏小,配制的溶液浓度偏低,故④错误;
⑤用量筒量取浓硫酸时仰视读数,导致量取的浓硫酸体积偏大,配制的溶液中溶质的物质的量偏大,溶液的浓度偏高,故⑤正确;
故答案为:①⑤;
(4)检验硫酸根离子时,需要使用氯化钡溶液,所以应该先加入盐酸,排除氯化银的干扰,正确的检验方法为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-,
故答案为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-.
点评:本题考查了配制一定物质的量浓度的溶液的方法、氧化还原反应的计算、硫酸根离子检验等知识,试题题量较大,知识点较多,该题是中等难度的试题,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 系统命名为
系统命名为 的炔烃的结构简式
的炔烃的结构简式 系统命名为
系统命名为
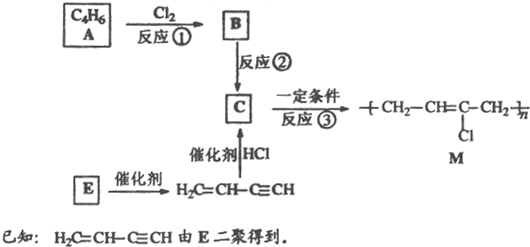
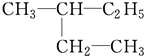 和
和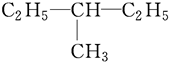
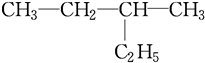 和
和