题目内容
在一定条件下,NO与NO2混合可生成N2O3,反应的化学方程式为:NO(g)+NO2(g)?N2O3(l)△H<0
如图表示一定量的NO、NO2混合气体发生反应时,NO2浓度在前25s内的变化.该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L.
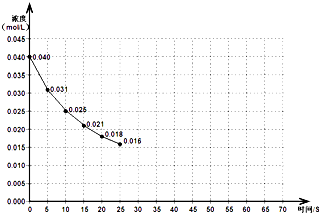
(1)前20s内,NO2的平均反应速率为 .
(2)其他条件不变,①升高温度,NO2的转化率 (填“增大”、“减小”或“不变”).
②压缩气体体积,该反应平衡向 移动(填“正向”或“逆向”).
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线.
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线.
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为: ,该反应的氧化剂是 .
如图表示一定量的NO、NO2混合气体发生反应时,NO2浓度在前25s内的变化.该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L.

(1)前20s内,NO2的平均反应速率为
(2)其他条件不变,①升高温度,NO2的转化率
②压缩气体体积,该反应平衡向
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线.
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线.
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的影响因素,氮的氧化物的性质及其对环境的影响
专题:化学平衡专题
分析:(1)根据前20s内,NO2浓度的变化量计算;
(2)根据外界条件对化学平衡移动的影响判断;
(3)反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L,据此画出曲线;
(4)加入催化剂,加快反应速率,达到化学平衡时,所需时间缩短,且平衡浓度不变;
(5))NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该盐的化合价介于NO、NO2的化合价之间;根据化合价变化判断氧化剂.
(2)根据外界条件对化学平衡移动的影响判断;
(3)反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L,据此画出曲线;
(4)加入催化剂,加快反应速率,达到化学平衡时,所需时间缩短,且平衡浓度不变;
(5))NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该盐的化合价介于NO、NO2的化合价之间;根据化合价变化判断氧化剂.
解答:
解:(1)根据前20s内,NO2浓度的变化量为0.040mol/L-0.018mol/L=0.022mol/L,则反应速率v=
=
=1.1×10-3 mol?L-1?s-1,
故答案为:1.1×10-3 mol?L-1?s-1;
(2)①△H<0,该反应放热,升高温度向逆反应方向移动,NO2的转化率减小,故答案为:减小;
②反应前气体体积大于反应后气体体积,增大压强向正反应方向进行,故答案为:正向;
(3)反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L,画出平滑曲线,故答案为: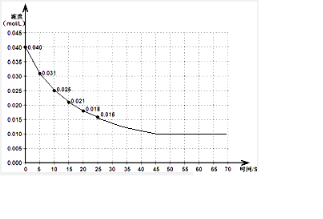
(4)加入催化剂,加快反应速率,达到化学平衡时,所需时间缩短,且平衡浓度不变,画出平滑曲线,故答案为: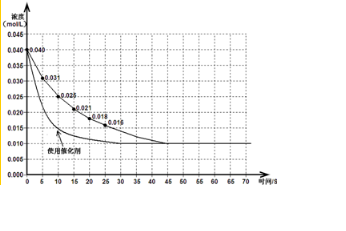
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该盐的化合价介于NO、NO2的化合价之间,则化合价为+3价,为亚硝酸盐,根据氧化还原化学方程式配平,写出离子方程式:NO+NO2+2OH-=2NO2-+H2O; NO2化合价降低,为氧化剂,故答案为:NO+NO2+2OH-=2NO2-+H2O;NO2.
| △c |
| △t |
| 0.022mol/L |
| 20s |
故答案为:1.1×10-3 mol?L-1?s-1;
(2)①△H<0,该反应放热,升高温度向逆反应方向移动,NO2的转化率减小,故答案为:减小;
②反应前气体体积大于反应后气体体积,增大压强向正反应方向进行,故答案为:正向;
(3)反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L,画出平滑曲线,故答案为:

(4)加入催化剂,加快反应速率,达到化学平衡时,所需时间缩短,且平衡浓度不变,画出平滑曲线,故答案为:

(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该盐的化合价介于NO、NO2的化合价之间,则化合价为+3价,为亚硝酸盐,根据氧化还原化学方程式配平,写出离子方程式:NO+NO2+2OH-=2NO2-+H2O; NO2化合价降低,为氧化剂,故答案为:NO+NO2+2OH-=2NO2-+H2O;NO2.
点评:本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大,注意掌握平衡移动原理.

练习册系列答案
相关题目

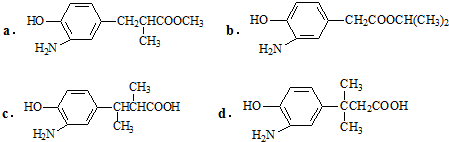
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: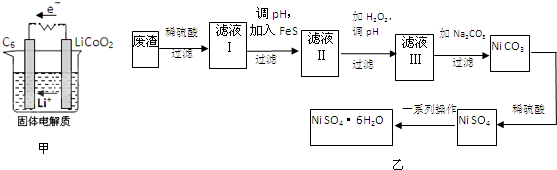
 碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: