题目内容
18.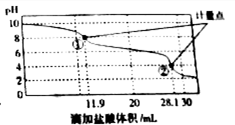 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
分析 A、同浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液的pH值大;
B、计量点①溶液显示碱性,据此确定发生的离子反应,再根据溶液的成份比较离子浓度;
C、计量点②溶液显示酸性,据此确定发生的离子反应,再根据溶液的成份确定离子,利用电荷守恒解答;
D、Na2CO3和NaHCO3混合物加盐酸,先是碳酸钠转化为碳酸氢钠,随后是碳酸氢钠转化为氯化钠的过程,据此计算.
解答 解:A、Na2CO3和NaHCO3混合物,Na2CO3含量越高,起始pH也越大,故A正确;
B、Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠,溶液显示碱性,溶液中CO32-发生的离子反应:CO32-+H+═HCO3-,此时消耗的盐酸的体积为11.9mL,溶液中含有NaHCO3和NaOH,离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-)故B正确;
C、Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-+H+═HCO3-,此时消耗的盐酸的体积为11.9mL,随后是碳酸氢钠转化为氯化钠的过程,HCO3-+H+═H2O+CO2↑,此时消耗的盐酸的体积为28.1mL,溶液中含有NaCl和H2CO3,由溶液中电荷守恒得:2(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)=c(H+)+c(Na+),又因为c(Cl-)=c(Na+),所以2(CO32-)+c(HCO3-)+c(OH-)=c(H+),故C正确;
D、Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-+H+═HCO3-,此时消耗的盐酸的体积为11.9mL,随后是碳酸氢钠转化为氯化钠的过程,HCO3-+H+═H2O+CO2↑,由于CO32-+H+═HCO3-过程和HCO3-+H+═H2O+CO2过程消耗的盐酸体积应该是相同的,所以样品中碳酸钠消耗的盐酸为2×11.9mL,则样品中碳酸氢钠消耗的盐酸n(HCl)=(28.1-2×11.9)×10-3L×0.1mol•L-1=(28.1-2×11.9)×10-4 mol,所以此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol×10=(28.1-2×11.9)×10-3 mol,故D错误;
故选D.
点评 本题考查学生碳酸钠和碳酸氢钠与盐酸之间的反应知识,注意反应的先后是解题的关键,注重学生读图能力的考查.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案| A. | NH3•H2O的电离平衡常数随着温度升高而减小 | |
| B. | 在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小 | |
| C. | 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质 | |
| D. | 相同温度下,醋酸溶液的导电能力可能比稀硫酸强 |
| A. | 中和时所需HCl的量 | B. | NH3•H2O的电离常数 | ||
| C. | OH-的物质的量 | D. | OH-的浓度 |
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
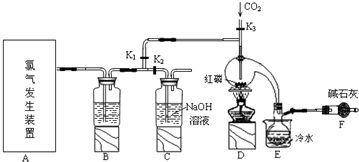
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见下表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)写出A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B装置中所盛试剂是浓硫酸;E中烧杯内冷水的作用是冷凝PCl3防止其挥发便于收集产品.
(3)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.其中通入干燥CO2的目的是排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应.
(4)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过蒸馏(填实验名称)即可得到较纯净的PCl3.
(5)实验后关闭K1,打开K2,将A、B中剩余氯气通入300ml 1mol/L的NaOH溶液中.若NaOH恰好完全反应,(假设反应生成了NaCl、NaClO 和 NaClO3 等钠盐),则反应中转移电子的物质的量(n)的范围是0.15mol<n<0.25mol.
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性的共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |