题目内容
9.下列有关叙述正确的是( )| A. | NH3•H2O的电离平衡常数随着温度升高而减小 | |
| B. | 在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小 | |
| C. | 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质 | |
| D. | 相同温度下,醋酸溶液的导电能力可能比稀硫酸强 |
分析 A.NH3•H2O的电离为吸热过程;
B.醋酸根离子抑制醋酸的电离;
C.活泼金属的氧化物属于强电解质;
D.溶液的导电性与溶液中离子浓度有关,与电解质的强弱无关.
解答 解:A.NH3•H2O的电离为吸热过程,升高温度促进电离,电离平衡常数增大,故A错误;
B.醋酸根离子抑制醋酸的电离,所以在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,醋酸的电离程度减小,溶液中氢离子浓度减小,溶液的pH增大,故B错误;
C.强酸、强碱和大部分盐类都是强电解质,活泼金属的氧化物属于强电解质,其他化合物不一定是弱电解质,如乙醇属于非电解质,故C错误;
D.溶液的导电性与溶液中离子浓度有关,与电解质的强弱无关,相同温度下,醋酸溶液中离子浓度大于硫酸中离子浓度时,醋酸溶液的导电能力比稀硫酸强,故D正确.
故选D.
点评 本题考查了弱电解质的电离、电解质与非电解质、溶液的导电性等,题目难度中等,注意把握影响弱电解质电离的因素,D为易错点,溶液的导电性与溶液中离子浓度有关,与电解质的强弱无关.

练习册系列答案
相关题目
10.下列各组微粒,半径大小比较中错误的是( )
| A. | K>K+ | B. | Na+>Mg2+>Al3+ | C. | Na+>F- | D. | Cl->Na+ |
11.W是由短周期元素X、Y、Z组成的盐.X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期.下列说法一定正确的是( )
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | W溶液显碱性或中性 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸. |
17.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol•L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol•L-1),当pH=7时,溶液中的酸恰好完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:④>①>②>③ |
4.已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
14.对于常温下pH=12的氨水,下列说法正确的是( )
| A. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
1. 25℃,电离平衡常数:
25℃,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是abdc(填编号)
(2)在Na2CO3溶液中通入少量的SO2气体,写出离子方程式2CO32-+SO2+H2O═2HCO3-+SO32-
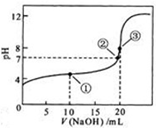
(3)用0.1000mol/L NaOH溶液滴定0.1000mol/L 20mL CH3COOH溶液,得到如图曲线在②时,溶液中离子浓度大小顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
在①时,测得pH约为5,c(CH3COO-)-c(Na+)=10-5-10-9mol/L(填精确数值)
(4)常温下,CH3COOH与NH3.H2O的电离平衡常数均为1.8×10-5,则NH4HCO3溶液呈碱性.
溴水.
 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是abdc(填编号)
(2)在Na2CO3溶液中通入少量的SO2气体,写出离子方程式2CO32-+SO2+H2O═2HCO3-+SO32-
(3)用0.1000mol/L NaOH溶液滴定0.1000mol/L 20mL CH3COOH溶液,得到如图曲线在②时,溶液中离子浓度大小顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
在①时,测得pH约为5,c(CH3COO-)-c(Na+)=10-5-10-9mol/L(填精确数值)
(4)常温下,CH3COOH与NH3.H2O的电离平衡常数均为1.8×10-5,则NH4HCO3溶液呈碱性.
溴水.
18.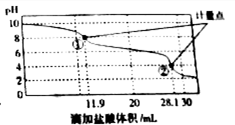 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
19.已知有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如下关系:则下列推断不正确的是( )
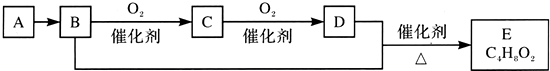

| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 | |
| D. | B+D→E的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 |