题目内容
8.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•Lˉ1、0.3mol•Lˉ1、0.2mol•Lˉ1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是(mol•Lˉ1)( )| A. | Z为0.3 | B. | Y2为0.4 | C. | X2为0.2 | D. | Z为0.4 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,故A正确、BCD错误.
故选A.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
18.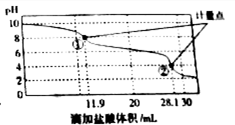 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
19.已知有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如下关系:则下列推断不正确的是( )
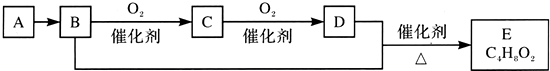

| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 | |
| D. | B+D→E的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 |
16.化学与环境保护密切相关,下列说法不正确的是( )
| A. | PM2.5是指大气中直径≤2,5微米的颗粒物也称为可入肺颗粒物,对人体危害最大是因为它可以直接进入肺泡 | |
| B. | 雾霾是因为汽车排放尾气,工厂排放废气,燃烧烟花爆竹、烹饪等原因所造成的 | |
| C. | 化石能源不仅不可再生,而且在燃烧过程中会产生染污性物质,因此应不再使用化石能源,这符合绿色化学的核心 | |
| D. | 对煤进行气化、液化、脱硫等处理,不仅可以提高其利用率,而且可以降低对环境的污染 |
13.下列事实能说明HA酸是弱电解质的是( )
| A. | HA溶液的导电性比强酸弱 | |
| B. | 10 mL 1 mol/L的HA溶液与10 mL 1 mol/L的NaOH溶液恰好完全反应 | |
| C. | NaA溶液的pH>7 | |
| D. | 0.1 mol/L HA溶液的pH=1 |
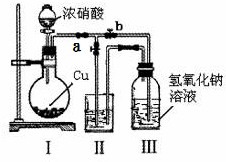 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:


