题目内容
14.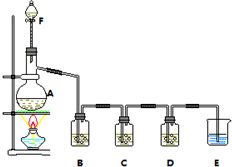 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大,I2(S)+I-?I3-(aq).
容器中盛放的试剂分别为:
A.MnO2
C.0.5000mol/L的KI溶液
D.AgNO3溶液
E.NaOH溶液
F.浓盐酸
完成下列填空:
(1)仪器A的名称蒸馏烧瓶,B中的试剂是饱和食盐水.
(2)当D装置中出现白色沉淀 时,停止加热;E的作用是吸收未反应的氯气.
(3)当氯气开始进入C时,C中看到的现象是溶液变棕黄色;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的原因被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出.
(4)持续不断地向C中通入氯气,看到C中液体逐渐澄清,最终呈无色.推测此时C中无色溶液里含碘物质的化学式HIO3(此时溶液中只有一种含碘微粒).
为确定含碘物质中碘元素的化合价,进行如下实验:
①取反应后C中溶液5.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸.
②向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.6250mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液24.00mL.
已知:I2+2S2O32-→2I-+S4O62-
计算:碘元素的化合价为+5.
(5)欲检验某溶液中是否含有I-,可使用的试剂为氯水和淀粉溶液.合理的实验操作为取样,滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡.
分析 F中的浓盐酸滴入烧瓶A中的二氧化锰中发生反应生成氯气、二氧化锰、水,生成的氯气中含氯化氢、水蒸气,通过B中的饱和食盐水除去氯化氢,通过C中KI溶液
,探究Cl2与KI溶液的反应,通过D装置中AgNO3溶液生成氯化银白色沉淀,最后剩余氯气通过氢氧化钠溶液吸收,不能排放到空气中,防止污染空气,
(1)A中是制备氯气的装置,所以A是蒸馏烧瓶;B是用来除去氯气中的氯化氢气体,所以用饱和食盐水.
(2)氯气的KI溶液反应之后,剩余的氯气进入硝酸银溶液,生成氯化银白色沉淀;未反应的氯气进入氢氧化钠溶液被吸收.
(3)氯气开始进入C时,将碘离子氧化成单质碘,所以开始溶液变棕黄色;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,因为被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出.
(4)氯气过量时会将碘继续氧化成HIO3;Na2S2O3的物质的量=0.625×0.024=0.015mol,C中原I-的物质的量=0.005×0.5=0.0025mol,设被氯气氧化为x价,据反应I2+2S2O32-→2I-+S4O62-,得反应的碘单质物质的量=0.015×$\frac{1}{2}$=0.0075mol,碘原子共0.015mol,x价碘生成的占0.0025mol,则碘离子生成的为0.015-0.0025=0.0125mol,据化合价升降相等得:0.0025x=0.0125,x=5,所以碘元素的化合价为+5价.
(5)检验某溶液中是否含有I-,取样,滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡.
解答 解:(1)A中是制备氯气的装置,依据仪器图形和用途可知A是蒸馏烧瓶,B中是用来除去氯气中的氯化氢气体,所以用饱和食盐水,
故答案为:蒸馏烧瓶,饱和食盐水;
(2)氯气的KI溶液反应之后,剩余的氯气进入硝酸银溶液,装置D中生成氯化银白色沉淀;未反应的氯气进入装置E中的氢氧化钠溶液被吸收,
故答案为:白色沉淀,吸收未反应的氯气;
(3)氯气开始进入C时,将碘离子氧化成单质碘,所以开始溶液变棕黄色;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,因为被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出,
故答案为:溶液变棕黄色,被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出;
(4)氯气过量时会将碘继续氧化成HIO3;Na2S2O3的物质的量=0.625×0.024=0.015mol,C中原I-的物质的量=0.005×0.5=0.0025mol,
设被氯气氧化为x价,据反应I2+2S2O32-→2I-+S4O62-,得反应的碘单质物质的量=0.015mol×$\frac{1}{2}$=0.0075mol,碘原子共0.015mol,
x价碘生成的占0.0025mol,则碘离子生成的为0.015-0.0025=0.0125mol,
据化合价升降相等得:0.0025x=0.0125,x=5,
所以碘元素的化合价为+5价,
故答案为:HIO3,+5;
(5)检验某溶液中是否含有I-,取样,滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡,
故答案为:取样滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡;
点评 本题考查了物质性质的实验设计过程分析判断,主要是氯气性质的理解应用,注意含碘物质中碘元素的化合价的确定和计算,题目难度中等.

| A. | CO2 | B. | H2O | C. | CO32- | D. | CCl4 |
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果偏高(填“偏高”、“偏低”或“无影响”).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
(2)根据表中所列实验原理,从如图装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等).
(4)在浓CaCl2溶液中通人NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是NH3,制取纳米级碳酸钙的化学方程式为CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是.
(5)制备Cl2需用8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.
①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)ACFGH.
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒F.胶头滴管G.100mL烧杯H.100mL容量瓶
③下列实验操作中.不正确的是BC(填写标号).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加人蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(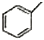 )的一氯代物 )的一氯代物 | D. | 立体烷(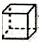 )的二氯代物 )的二氯代物 |
 ,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m-1-a |
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |

