题目内容
15.下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( )| A. | CO2 | B. | H2O | C. | CO32- | D. | CCl4 |
分析 价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:A.CO2分子中每个O原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2,且不含孤电子对,为直线形结构,VSEPR模型与分子立体结构模型一致,故A不选;
B.水分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,故B选;
C.CO32-的中心原子C原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(4+2-2×3)=0,所以CO32-的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,故B不选;
D.CCl4分子中中心原子C原子原子价层电子对个数=σ键个数+孤电子对个数=4+$\frac{1}{2}$(4-1×4)=4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,故D不选;
故选B.
点评 本题考查了价层电子对互斥模型和微粒的空间构型的关系,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错点,注意实际空间构型要去掉孤电子对为解答关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案①混合物:氯水、氨水、水玻璃、水银
②电解质:明矾、冰醋酸、石膏、纯碱
③同位素:1H+、2H+、3H+
④同素异形体:C60、C80、金刚石、石墨.
| A. | ①④ | B. | ②③④ | C. | ②④ | D. | 全部正确 |
①R元素的最高正价是+5价
②R元素还可形成其他含氧酸
③R元素原子的最外层电子数为7
④R元素的原子序数为7.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |


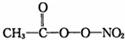 (PAN)等二次污染物.
(PAN)等二次污染物.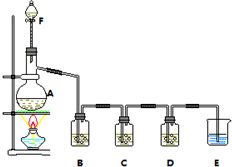 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.