题目内容
9. 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
(2)根据表中所列实验原理,从如图装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等).
(4)在浓CaCl2溶液中通人NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是NH3,制取纳米级碳酸钙的化学方程式为CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是.
(5)制备Cl2需用8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.
①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)ACFGH.
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒F.胶头滴管G.100mL烧杯H.100mL容量瓶
③下列实验操作中.不正确的是BC(填写标号).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加人蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
分析 (1)反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备;
(2)根据反应物的状态和反应条件确定反应装置;
(3)实验室用H2O2制备氧气,为固体和液体在不加热条件下反应;
(4)根据氨气和二氧化碳在水中的溶解度判断,胶体具有丁达尔效应;
(5)①根据溶液稀释前后溶质的物质的量不变进行计算;
②根据用液体物质配制一定质量分数的溶液步骤有:计算、量取、稀释分析解答;
③容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液.
解答 解:(1)反应③氯元素化合价升高,必须加入氧化剂才能实现;反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:NH3;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)反应①为液体不加热制取气体的装置,故选C;反应②为固固加热制取气体的装置,故选B;反应③为固液加热或不加热制取气体,故选A或C,
故答案为:
| 编号 | 发生装置 |
| ① | C |
| ② | B |
| ③ | A或C |
(3)实验室用H2O2制备氧气,为固体和液体在不加热条件下反应,如用制备氧气的装置制备氨气,可用浓氨水和氢氧化钠(或生石灰或碱石灰),开用氢氧化钠或生石灰或碱石灰吸水放热的特点制备氨气,
故答案为:浓氨水和氢氧化钠(或生石灰等);
(4)氨气极易溶于水,而二氧化碳微溶于水,制取时应先通入NH3;碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;胶体具有丁达尔效应,可取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是,
故答案为:NH3;CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是;
(5)①溶液稀释前后溶质的物质的量不变,则有8mol/L×0.1L=V×12mol/L,V=0.0667L=66.7mL,
故答案为:66.7;
②用12mol•L-1的盐酸配制8mol•L-1的盐酸100mL,所要用到的仪器有:量筒、胶头滴管、烧杯、玻璃棒、容量瓶,即:ACFGH,
故答案为:ACFGH;
③容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液,容量瓶在使用前要检查是否漏水,定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次,使溶液充分混合,则不正确的是BC,
故答案为:BC.
点评 本题考查制备方案的设计,题目难度中等,涉及物质的制备、实验装置的选用、溶液的配制等知识,明确常见物质性质及制备方法为解答关键,注意掌握配制一定浓度的溶液方法,(4)为易错点,可类比侯氏制碱法分析,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.奶粉行业的“911事件”将三聚氰胺引入公众视野,工业上可用尿素为原料,在一定条件下合成三聚氰胺:(C3H6N6),对说法正确的是( )
| A. | 摩尔质量为126 | |
| B. | 式量为126 | |
| C. | 每个C3H6N6分子含3个N2分子 | |
| D. | 0.1NA个C3H6N6分子含碳原子数为1.806×1023 |
4.足量的镁条分别在体积相同的①O2、②N2、③CO2充分燃烧,所得固体的质量由大到小的正确顺序是( )
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
18.下列表示溶液中发生反应的方程式错误的是( )
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
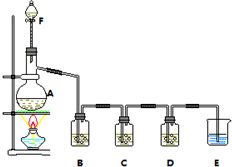 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图. .
.