题目内容
19.氮是地球上较为丰富的元素,其单质及化合物有重要的用途.(1)工业上利用分离液态空气的方法得到氮气,从液态空气中得到氮气的方法为分馏.
(2)①肼(N2H4)又称联氨,是良好的火箭燃料,NH3和NaClO反应可得到肼,该反应的化学方程式为2NH3+NaClO═N2H4+NaCl+H2O,该反应的氧化剂为NaClO.
②肼被亚硝酸(HNO2)氧化时可生成叠氮酸(HN3),该反应的化学方程式为N2H4+HNO2═HN3+2H2O.
(3)叠氮酸(HN3)常用作引爆剂,受到撞击时爆炸分解成常见的两种单质,分解时的化学方程式2HN3=H2↑+3N2↑.
(4)如图是工业上合成硝酸铵的流程图.

上述A、B、C、D四个容器中发生的反应,不属于氧化还原反应的是ABC.
分析 (1)工业制氮气的原理是分离液态空气,其方法是将空气加压降温成液态空气,然后略微升温,沸点低的先逸出;
(2)①NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,Cl元素的化合价降低;
②肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,据此书写化学方程式;
(3)氢叠氮酸(HN3)只由两种元素构成,故受撞击时爆炸分解成常见的两种单质为氢气和氮气,据此书写反应;
(4)根据反应中各物质的组成元素的化合价是否发生变化来判断是否发生氧化还原反应.
解答 解:(1)氧气的沸点是-183℃,氮气的沸点是-196℃,工业制氮气的原理是分离液态空气,其方法是将空气加压降温成液态空气,然后略微升温,沸点低的氮气先逸出,此方法为液态空气的分馏,
故答案为:分馏;
(2)①NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,Cl元素的化合价降低,则NaClO氧化剂;
故答案为:NaClO;
②肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,故化学方程式为N2H4+HNO2═HN3+2H2O,
故答案为:N2H4+HNO2═HN3+2H2O;
(3)氢叠氮酸(HN3)只由两种元素构成,故受撞击时爆炸分解成常见的两种单质为氢气和氮气,故化学方程式为:2HN3=H2↑+3N2↑,
故答案为:2HN3=H2↑+3N2↑;
(4)题中涉及的化学反应有:A、N2+3H2?2NH3,B、4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,C、2NO+O2═2NO2、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3,D、NH3+HNO3═NH4NO3,其中A、B、C属于氧化还原反应,
故答案为:ABC.
点评 本题考查了氧化还原反应的判断、化学方程式的书写等知识,题目难度稍大,试题题量较大,涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案


 在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.
在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.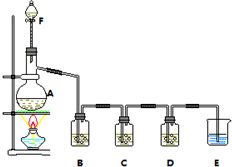 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.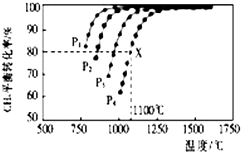 在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.
在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.

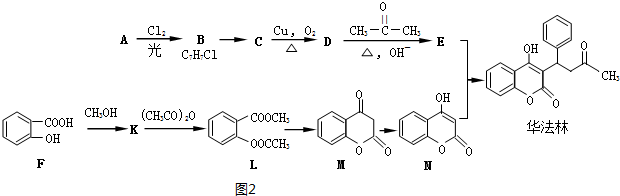
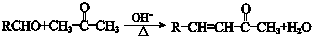
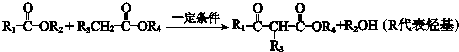
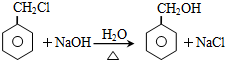 ;
;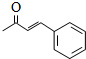 .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.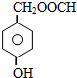 .
.