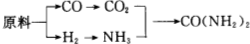题目内容
2.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂.请填写下列空白:(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果偏高(填“偏高”、“偏低”或“无影响”).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
分析 (1)没有润洗滴定管,导致标准液被稀释,滴定过程中消耗的标准液体积偏大;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
(3)计算出三次滴定消耗标准液体积,然后舍弃数据较大的一组,然后计算出另外两组的平均值,最后根据中和反应实质计算出该氢氧化钠溶液的浓度.
解答 解:(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,导致标准液被稀释,则滴定过程中消耗标准液的体积偏大,计算出的滴定结果偏高,
故答案为:偏高;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,以便及时判断滴定终点,所以B正确,
故答案为:B;
(3)三次滴定消耗标准液体积分别为:26.11mL-0.00mL=26.11mL、30.30mL-1.56mL=28.74mL、26.31mL-0.22mL=26.09mL,第二组数据误差较大,应该舍弃,另外两组实验中消耗标准液平均体积为:$\frac{26.11mL+26.09mL}{2}$=26.10mL,
则该氢氧化钠溶液的物质的量浓度为:$\frac{0.1000mol/L×0.0261L}{0.025L}$=0.1044mol/L,
故答案为:0.1044.
点评 本题主要考查中和滴定,题目难度不大,明确滴定操作、指示剂的选择、数据处理及误差分析是解答本题的关键,注意掌握酸碱中和的实质,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
3.某元素R的原子序数小于18,该元素的原子得到1个电子后形成具有稀有气体元素原子的电子层结构的离子,该元素可形成含氧酸HRO3,下列说法中正确的是( )
①R元素的最高正价是+5价
②R元素还可形成其他含氧酸
③R元素原子的最外层电子数为7
④R元素的原子序数为7.
①R元素的最高正价是+5价
②R元素还可形成其他含氧酸
③R元素原子的最外层电子数为7
④R元素的原子序数为7.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
4.已知某有机物(分子式为C5H10O2)嫩发生水解反应生成甲和乙,乙能与氧气在催化剂Cu的作用下反应生成丙.若甲、丙都不能发生银镜反应,则符合条件的该有机物有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
17.奶粉行业的“911事件”将三聚氰胺引入公众视野,工业上可用尿素为原料,在一定条件下合成三聚氰胺:(C3H6N6),对说法正确的是( )
| A. | 摩尔质量为126 | |
| B. | 式量为126 | |
| C. | 每个C3H6N6分子含3个N2分子 | |
| D. | 0.1NA个C3H6N6分子含碳原子数为1.806×1023 |
12.某有机物结构简式如图,下列关于该有机物的说法正确的是( )


| A. | lmol该有机物可消耗3mol NaOH | B. | 该有机物的分子式为C16H1705 | ||
| C. | 最多可与7molH2发生加成 | D. | 苯环上的一溴代物有6种 |

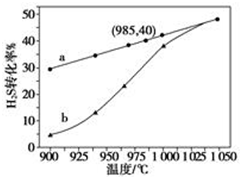 在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.
在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.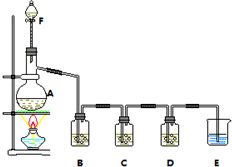 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.