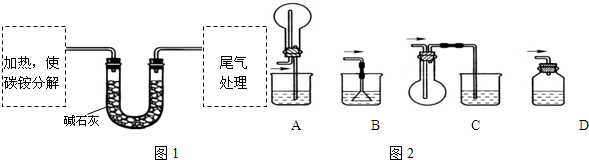
题目内容
4.化学与生产生活密切相关,下列说法不正确的是( )| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
分析 A、氯化钠左调味剂,属于易溶于水的强电解质;
B、聚乙烯无毒,是食品保鲜膜、一次性食品袋的主要成分;
C、判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化;
D、铝合金的性能:强度大、质量轻、抗腐蚀能力强等.
解答 解:A、食盐可以作为调味剂,属于易溶于水的强电解质,也可以调节体液电解质平衡,故A正确;
B、聚乙烯无毒,是食品保鲜膜、一次性食品袋的主要成分,故B正确;
C、煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程.有新的物质生成,属于化学变化,石油分馏是利用沸点不同使混合物分离的过程,没有新物质生成,属于物理变化,天然气生产甲醇属于化学变化,故C错误;
D、铝合金具有强度大、质量轻、抗腐蚀能力强等性能,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用,故D正确.
故选C.
点评 本题主要考查了生活的化学相关的知识,掌握物质的性质以及应用知识是解答的关键,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
15.以铂为阳极,铜为阴极,电解硫酸铜溶液,在阳极和阴极上析出物质的质量比是( )
| A. | 1:2 | B. | 8:1 | C. | 1:4 | D. | 4:1 |
12.某有机物结构简式如图,下列关于该有机物的说法正确的是( )


| A. | lmol该有机物可消耗3mol NaOH | B. | 该有机物的分子式为C16H1705 | ||
| C. | 最多可与7molH2发生加成 | D. | 苯环上的一溴代物有6种 |
16.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3( g)、BBr3等].
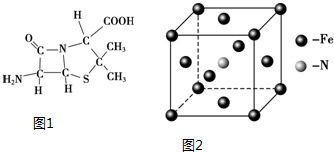
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(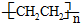 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2.若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}N{\;}_{A}}$g•mol-1.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3( g)、BBr3等].
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
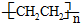 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
14.关于石油和石油化工的说法错误的是( )
| A. | 石油大体上是由各种碳氢化合物组成的混合物 | |
| B. | 石油分馏得到的各馏分是由各种碳氢化合物组成的混合物 | |
| C. | 石油裂解和裂化的主要目的都是为了得到重要产品乙烯 | |
| D. | 实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油 |
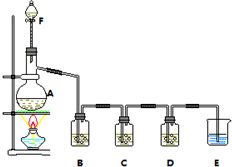 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.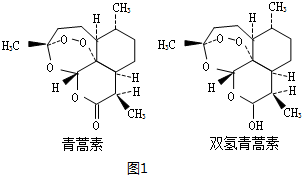
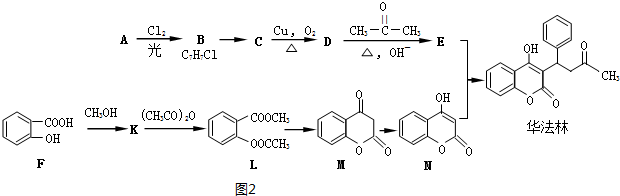
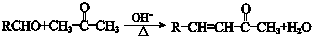
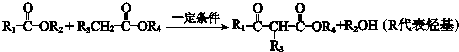
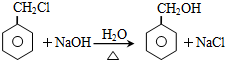 ;
; .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.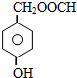 .
.