题目内容
11.某烃的结构简式如下: 分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )
分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )| A. | 4、4、7 | B. | 4、3、6 | C. | 3、5、4 | D. | 2、6、4 |
分析 由结构可知,分子中含碳碳双键和三键,双键为平面结构,三键为直线结构,其它C均为四面体构型,以此来解答.
解答 解: 中,处于四面体中心位置的碳原子数为a,甲基、亚甲基均为四面体构型,则a=4;
中,处于四面体中心位置的碳原子数为a,甲基、亚甲基均为四面体构型,则a=4;
与三键直接相连的C共线,一定在同一直线上的碳原子个数为b,则b=3,
含有碳碳双键共面,含碳碳三键的共线,且二者直接相连,一定共面,一定在同一平面上的碳原子数为c,所以一定在同一平面内的碳原子数为6个,即c=6,
故选B.
点评 本题考查有机物的结构,为高频考点,把握原子的共线、共面为解答的关键,侧重分析与应用能力的考查,注意常见有机物的空间结构,题目难度不大.

练习册系列答案
相关题目
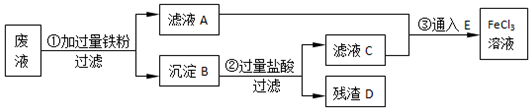
2.FeCl3溶液是实验室中使用比较广泛的一种试剂,下列有关离子方程式正确的是( )
| A. | FeCl3溶液使蓝色石蕊试纸变红:Fe3++3H2O═3H++Fe(OH)3 | |
| B. | FeCl3溶液中滴加氨水出现红褐色沉淀:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| D. | 检验溶液中的Fe3+用KSCN溶液:Fe3++3SCN-?Fe(SCN)3 |
19.X、T、Y、Z为1-36号元素,且原子序数依次增大,四种元素的性质或结构信息如表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图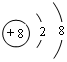 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
(2)Y单质与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
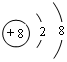 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.(2)Y单质与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.