题目内容
20.足量Zn粉与50ml、0.1mol/L的稀硫酸充分反应.为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )①加Na2SO4溶液;②改用50ml、0.1mol/L的稀盐酸;③改用50ml、0.05mol/L的硝酸;④加适量Na2CO3溶液;⑤冰水浴.
| A. | ① | B. | ①⑤ | C. | ①②⑤ | D. | ①②③⑤ |
分析 为了降低此反应速率而不改变H2的产量,少量Zn粉完全反应,则可降低氢离子浓度、降低温度等来降低反应速率,以此来解答.
解答 解:①加Na2SO4溶液,氢离子浓度降低,反应速率减小,氢气的量不变,故正确;
②改用50mL、0.1mol/L的稀盐酸,浓度减小,反应速率减小,生成氢气的量减小,故错误;
③改用50mL、0.05mol/L的硝酸,不生成氢气,生成NO气体,故错误;
④加Na2CO3溶液,消耗硫酸,生成氢气的总量减小,
⑤冰水浴,反应温度降低,反应速率减小,氢气的总量不变,故正确.
故选B.
点评 本题考查影响反应速率的因素,明确常见的温度、浓度、原电池对反应速率的影响即可解答,注意Zn粉过量,生成的氢气由硫酸决定为解答的易错点,难度不大.

| A. | 标准状况下,11.2LH2O 含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 含有NA个氩原子的氩气在标准状况下的体积约为11.2L | |
| D. | 25℃,1.01×105 Pa,64gSO2中含有的原子数为3NA |
 分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )
分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )| A. | 4、4、7 | B. | 4、3、6 | C. | 3、5、4 | D. | 2、6、4 |
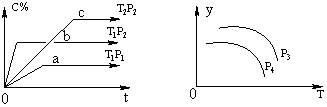
| A. | p3>p4,y轴表示A的物质的量分数 | |
| B. | 若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体 | |
| C. | p3<p4,y轴表示平衡常数K | |
| D. | p3>p4,y轴表示混合气体的平均摩尔质量 |
| A. | 用食醋清洗热水瓶中的水垢【主要成分是CaCO3和Mg(OH)2】 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| D. | 牛奶久置变质腐败 |
某学生用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)若移取20.00mL待测液注入有水的锥形瓶中,会导致结果(填“偏大”、“偏小”或“无影响”) 。
(3)判断滴定终点的现象是: 。

(4)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(5)根据下列数据:
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 0.00 | 22.60 |
第三次 | 20.00 | 4.00 | 24.00 |
请计算待测盐酸溶液的浓度: mol/L。