题目内容
14.工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2•6H2O的工艺流程如下: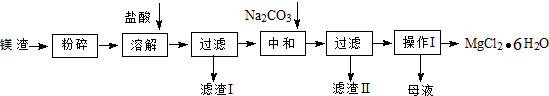
(1)写出溶解过程中发生反应的离子方程式MgO+2H+=H2O+Mg2+
(2)滤渣Ⅱ的主要成分是Fe(OH)3、CaCO3和BaCO3(填化学式).
(3)燥作X包括蒸发浓缩、冷却结晶、过滤、洗涤并烘干晶体;在洗涤MgCl2•6H2O晶体时用冰水洗涤的目的是减少因溶解而使产品损失.
(4)溶解时温度控制在35℃左右,温度不宜过高或过低的原因是既要防止Mg2+水解,同时又要保持适当的溶解速率.
(5)将MgCl2•6H2O制成无水氯化镁的方法是将MgCl2•6H2O晶体在氯化氢气流中加热.
分析 镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质),粉碎后用盐酸溶解,过滤除去不溶性杂质,得KCl、MgCl2、BaCl2、CaCl2、FeCl3等溶液,再加入碳酸钠进行中和,过滤,得滤渣Ⅱ为Fe(OH)3、CaCO3和BaCO3沉淀,和滤液为氯化钠、氯化镁、氯化钾的混合溶液,将混合溶液进行蒸发浓缩、冷却结晶、过滤、洗涤并烘干得MgCl2•6H2O晶体,
(1)镁渣用盐酸溶解时,主是里面的MgO和盐酸发生反应,形成主要含镁盐的溶液;
(2)滤渣Ⅱ为氢氧化铁和碳酸钡沉淀;
(3)操作I主要是从溶液中获得MgCl2•6H2O晶体,要经过蒸发浓缩、冷却结晶、过滤、洗涤并烘干等步骤,氯化镁能溶于水,所以在洗涤时要减少因溶解而使产品损失;
(4)溶解时要保持适当的温度,温度过低难溶解,MgCl2•6H2O晶体中镁离子易水解,温度越高水解程度越大,所以溶解时既要防止Mg2+水解,同时又要保持适当的溶解速率;
(5)MgCl2•6H2O晶体中镁离子易水解,所以MgCl2•6H2O制成无水氯化镁时,要抑制镁离子的水解,据此答题;
解答 解:镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质),粉碎后用盐酸溶解,过滤除去不溶性杂质,得KCl、MgCl2、BaCl2、CaCl2、FeCl3等溶液,再加入碳酸钠进行中和,过滤,得滤渣Ⅱ为Fe(OH)3、CaCO3和BaCO3沉淀,和滤液为氯化钠、氯化镁、氯化钾的混合溶液,将混合溶液进行蒸发浓缩、冷却结晶、过滤、洗涤并烘干得MgCl2•6H2O晶体,
(1)镁渣用盐酸溶解时,主是里面的MgO和盐酸发生反应,形成主要含镁盐的溶液,反应方程式为:MgO+2H+=H2O+Mg2+,
故答案为:MgO+2H+=H2O+Mg2+;
(2)根据上面的分析可知,滤渣Ⅱ为Fe(OH)3、CaCO3和BaCO3沉淀,
故答案为:Fe(OH)3、CaCO3和BaCO3;
(3)操作I主要是从溶液中获得MgCl2•6H2O晶体,要经过蒸发浓缩、冷却结晶、过滤、洗涤并烘干等步骤,氯化镁能溶于水,所以在洗涤时要减少因溶解而使产品损失,
故答案为:蒸发浓缩、冷却结晶;减少因溶解而使产品损失;
(4)溶解时要保持适当的温度,温度过低难溶解,MgCl2•6H2O晶体中镁离子易水解,温度越高水解程度越大,所以溶解时既要防止Mg2+水解,同时又要保持适当的溶解速率,
故答案为:既要防止Mg2+水解,同时又要保持适当的溶解速率;
(5)将MgCl2•6H2O制成无水氯化镁的方法是将MgCl2•6H2O晶体在氯化氢气流中加热,可得无水MgCl2,
故答案为:将MgCl2•6H2O晶体在氯化氢气流中加热.
点评 本题通过工业流程形式考查了学生对元素及其化合物知识灵活运用的能力,有一定综合性,中等难度,关键是要把化学原理的内容与实验过程有机结合起来解决问题.

| A. | 同位素:14C与14N | |
| B. | 同系物:丙烷、异丁烷、新戊烷 | |
| C. | 电解质:冰醋酸、水银、烧碱 | |
| D. | 酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
| A. | 已知X在一定条件下转化为Y,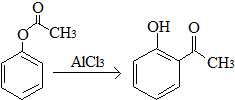 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 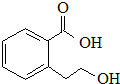 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 | |
| C. | 淀粉、蛋白质最终的水解产物都只有一种 | |
| D. | 香柠檬粉具有抗氧化功能,结构为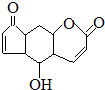 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH |
| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋加入豆浆中有沉淀产生 | ||
| C. | pH 试纸显示白醋的 pH 为 2~3 | D. | 蛋壳浸泡在白醋中有气体放出 |
| A. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
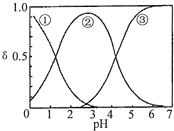 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(Ca2+)不变,c(C2O42-)将减小.(CaC2O4难溶于水) |
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的标准燃烧热为-483.6kJ/mol | |
| B. | △H的数值与化学反应方程式的化学计量系数无关 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 己知C(s)+O2(g)═CO2(g)△H1;C(g)+O2(g)═CO2(g)△H2,则△H1<△H2 |
| A. | C6H6 | B. | 蛋白质 | C. | H2CO3 | D. | CH3Cl |
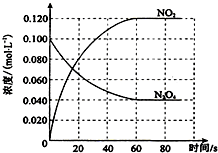 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.