题目内容
4.下列各组物质的分类正确的是( )| A. | 同位素:14C与14N | |
| B. | 同系物:丙烷、异丁烷、新戊烷 | |
| C. | 电解质:冰醋酸、水银、烧碱 | |
| D. | 酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
分析 A.同位素是具有相同质子数不同中子数的一类原子;
B.同系物是具有相同结构而分子组成相差一个或若干个CH2原子团的有机化合物;
C.电解质是在水溶液或熔融状态下能导电的化合物;
D.酸性氧化物是能与碱反应生成盐和水的氧化物.
解答 解:A.14C与14N质子数不同,分别为6、7,故A错误;
B.同系物是具有相同结构而分子组成相差一个或若干个CH2原子团的有机化合物,丙烷、异丁烷、新戊烷都属于烷烃,结构相似,但分子式不同,为同系物,故B正确;
C.电解质是在水溶液或熔融状态下能导电的化合物,水银是单质,既不是电解质,也不是非电解质,故C错误;
D.酸性氧化物是能与碱反应生成盐和水的氧化物,NO不能与碱反应,是不成盐氧化物,故D错误;
故选B.
点评 本题考查同位素、同系物、电解质、酸性氧化物等概念,题目较为简单,学习中注意对概念的理解要准确.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.将盛有16mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余6mL无色气体,则原混合气体中O2的体积是( )
| A. | 2mL | B. | 4mL | C. | 6mL | D. | 8mL |
15.图标所警示的是( )


| A. | 氧化物 | B. | 易燃物质 | C. | 自燃物质 | D. | 爆炸物质 |
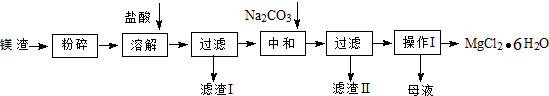
19.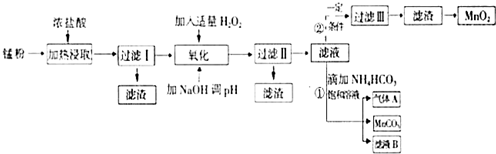 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
根据以上信息回答问题:
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时PH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
9.日常生活中常用到加碘食盐、含氟牙膏等,这里的碘或氟应理解为( )
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 分子 |
13. 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
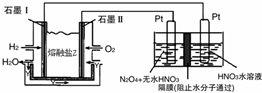
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为13.44L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1> K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是AC(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O?[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是ABD(填序号).
A.c(Cl-)>c(N2H62+)>c(OH-)>c(H+)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为13.44L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)2 | 4.1×106 | K1 | K2 | … |
①已知该反应能够自发进行,试比较K1、K2的大小:K1> K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是AC(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O?[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是ABD(填序号).
A.c(Cl-)>c(N2H62+)>c(OH-)>c(H+)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)