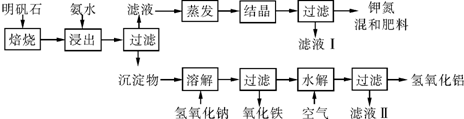
题目内容
2.用食用白醋(醋酸浓度约1mol/L)进行下列实验,能证明醋酸为弱电解质的是( )| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋加入豆浆中有沉淀产生 | ||
| C. | pH 试纸显示白醋的 pH 为 2~3 | D. | 蛋壳浸泡在白醋中有气体放出 |
分析 强弱电解质的根本区别是其电离程度,只要能证明醋酸部分电离就能证明醋酸是弱电解质,可以根据一定浓度醋酸pH、醋酸钠溶液酸碱性等方法判断.
解答 解:A.白醋中滴入石蕊试液呈红色说明醋酸电离出氢离子而使溶液呈酸性,证明醋酸是酸,但不能说明其电离程度大小,所以不能证明醋酸是弱电解质,故A错误;
B.白醋加入豆浆中有沉淀产生,说明醋酸是电解质,不能说明醋酸电离程度,所以不能证明醋酸是弱电解质,故B错误;
C.pH 试纸显示白醋的 pH 为 2~3,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则证明醋酸是弱电解质,故C正确;
D.蛋壳浸泡在白醋中有气体放出,说明醋酸酸性大于碳酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故D错误;
故选C.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质根本区别是解本题关键,注意:不能根据电解质溶解性强弱判断电解质强弱,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.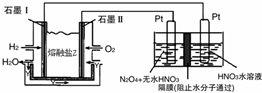 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为13.44L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1> K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是AC(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O?[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是ABD(填序号).
A.c(Cl-)>c(N2H62+)>c(OH-)>c(H+)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为13.44L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)2 | 4.1×106 | K1 | K2 | … |
①已知该反应能够自发进行,试比较K1、K2的大小:K1> K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是AC(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O?[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是ABD(填序号).
A.c(Cl-)>c(N2H62+)>c(OH-)>c(H+)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
10.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 打开汽水瓶.有气泡从溶液中冒出 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集 | |
| D. | 合成氨工业采用高压条件 |
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.56g Na2O2含有的阴离子数为0.02NA | |
| B. | 标准状况下,22.4L SO3含有的分子数为NA | |
| C. | 0.1mol氯气参与反应,转移的电子数一定为0.2NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Clˉ个数为NA |
11.下列关于浓硫酸的叙述正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 蓝色的胆矾晶体中加入浓硫酸,晶体会转化为白色固体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 常温下,浓硫酸不与铁、铝反应,所以可以用铁、铝制容器盛装浓硫酸 |
12.水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、SO42- | B. | H+、Na+、Fe2+、NO3- | ||
| C. | K+、Cu2+、NO3-、OH- | D. | H+、NH4+、AlO2-、SO42- |