题目内容
5.下列说法正确的是( )| A. | 已知X在一定条件下转化为Y,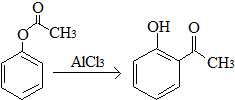 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 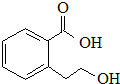 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 | |
| C. | 淀粉、蛋白质最终的水解产物都只有一种 | |
| D. | 香柠檬粉具有抗氧化功能,结构为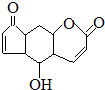 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH |
分析 A.酚可以和铁盐发生显色反应;
B.该物质中含有苯环、醇羟基、羧基,具有苯、醇和羧酸性质;
C.淀粉最终水解生成葡萄糖,蛋白质最终生成氨基酸,但氨基酸都多种结构;
D.该物质中能和溴发生反应的只有碳碳双键,能和氢氧化钠反应的有酯基水解生成的羧基.
解答 解:A.酚可以和铁盐发生显色反应,X不含酚羟基、Y含有酚羟基,所以Y能和氯化铁发生显色反应,但X不能发生显色反应,所以可以用氯化铁鉴别,故A正确;
B.该物质中含有苯环、醇羟基、羧基,具有苯、醇和羧酸性质,能发生加成反应、取代反应、消去反应、缩聚反应、酯化反应,但不能发生水解反应,故B错误;
C.淀粉最终水解生成葡萄糖,蛋白质最终生成氨基酸,但氨基酸都多种结构,所以蛋白质最终水解产物不一定是一种,故C错误;
D.该物质中能和溴发生反应的只有碳碳双键,能和氢氧化钠反应的有酯基水解生成的羧基,所以它与溴水发生反应,1mol最多消耗2molBr2,它与NaOH溶液反应,1mol最多消耗1molNaOH,故D错误;
故选A.
点评 本题考查物质结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、羧酸、醇及烯烃性质,易错选项是D,注意该物质中不含酚羟基,没有酚的性质,为易错题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.图标所警示的是( )


| A. | 氧化物 | B. | 易燃物质 | C. | 自燃物质 | D. | 爆炸物质 |
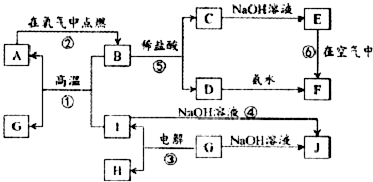
13.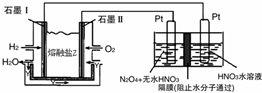 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为13.44L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1> K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是AC(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O?[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是ABD(填序号).
A.c(Cl-)>c(N2H62+)>c(OH-)>c(H+)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为13.44L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)2 | 4.1×106 | K1 | K2 | … |
①已知该反应能够自发进行,试比较K1、K2的大小:K1> K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是AC(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O?[N2H5•H2O]++H+;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是ABD(填序号).
A.c(Cl-)>c(N2H62+)>c(OH-)>c(H+)
B.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
20.下列关于安全事故的处理方法中,正确的是 ( )
| A. | 金属钠着火时,立即用水喷洒 | |
| B. | 大量氯气泄漏时,迅速离开现场,并尽量往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
10.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 打开汽水瓶.有气泡从溶液中冒出 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集 | |
| D. | 合成氨工业采用高压条件 |
15.下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25<t1<t2,则t1℃时纯水中c (H+)=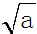 mol•L-1.
mol•L-1.
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至100mL,则稀释后溶液中c (Na+):c (OH-)=100:1
(3)t2℃下,将pH=10的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:2.此溶液中各种离子的浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则t1℃时纯水中c (H+)=
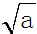 mol•L-1.
mol•L-1.(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至100mL,则稀释后溶液中c (Na+):c (OH-)=100:1
(3)t2℃下,将pH=10的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:2.此溶液中各种离子的浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-).