题目内容
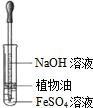
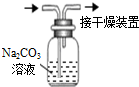
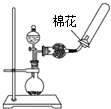
7.如表实验装置及操作 (略去部分夹持仪器)正确的是( )| A.观察Fe(OH)2 的生成 | B.中和滴定 | C.除去CO2气体中 的HCl气体 | D.制取并收集干燥 的氨气 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaOH和硫酸亚铁反应生成Fe(OH)2白色沉淀,Fe(OH)2不稳定,易被空气氧化生成红褐色Fe(OH)3;
B.盛放酸性溶液的滴定管应该是酸式滴定管;
C.HCl和二氧化碳都与碳酸钠反应;
D.可用浓氨水和生石灰制备氨气,导管应插入试管底部.
解答 解:A.NaOH和硫酸亚铁反应生成Fe(OH)2白色沉淀,Fe(OH)2不稳定,易被空气氧化生成红褐色Fe(OH)3,植物油密度小于水且和水不互溶,所以植物油能防止氢氧化亚铁被氧化,故A正确;
B.盛放酸性溶液的滴定管应该是酸式滴定管,该实验使用的是碱式滴定管,故B错误;
C.HCl和二氧化碳都与碳酸钠反应,应该用饱和碳酸氢钠溶液除去二氧化碳中的HCl,故C错误;
D.可用浓氨水和生石灰制备氨气,氨气的密度比空气小,用向下排空法收集,但导管应插入试管底部,故D错误;
故选A.
点评 本题考查较为综合,涉及物质制备、物质的分离提纯、仪器的选取、气体收集等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
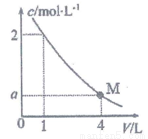
15.常温下,向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )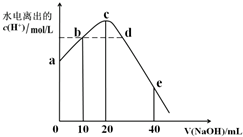

| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | a、d对应的纵坐标数值分别是:>10-12、>10-7 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 |
19.下列离子方程式正确的是( )
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向AlCl3溶液中投入过量Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| C. | 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有:CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑.
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10.
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
(1)上述实验中发生反应的化学方程式有:CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑.
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
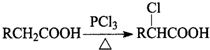
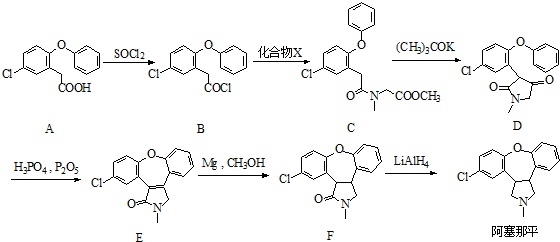
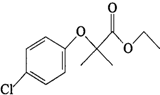 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下: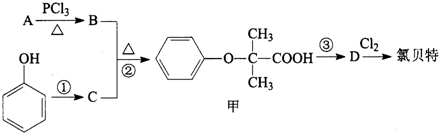
 .
.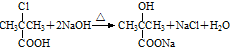 .
.
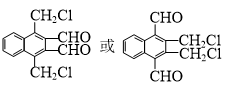 .
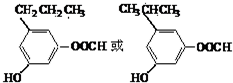
.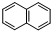 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;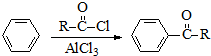 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和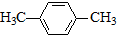 为原料制备
为原料制备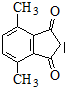 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种. 香叶醇是合成玫瑰精油的主要原料,其结构简式如下:
香叶醇是合成玫瑰精油的主要原料,其结构简式如下: