题目内容
19.下列离子方程式正确的是( )| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向AlCl3溶液中投入过量Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| C. | 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
分析 A.次氯酸具有强氧化性,能够将亚硫酸氢根离子氧化成硫酸根离子;
B.钠过量,氯化铝与氢氧化钠反应生成偏铝酸钠;
C.氯气少量,只有亚铁离子参与反应;
D.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子.
解答 解:A.向NaClO溶液中通入过量SO2,二者发生氧化还原反应,正确的离子方程式为:ClO-+SO2+H2O═Cl-+2H++SO42-,故A错误;
B.向AlCl3溶液中投入过量Na,反应生成偏铝酸钠、氢气,反应的离子方程式为:Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故B正确;
C.向FeBr2溶液中通入少量Cl2,亚铁离子的还原性大于溴离子,只有亚铁离子被氧化,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C错误;
D.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
10.下列物质性质与应用对应关系正确的是( )
| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有吸水性,可用于干燥CO2 | |
| C. | 铝具有高熔点,可用于生产耐火砖 | |
| D. | 硅有导电性,可用作光导纤维 |
14.电解质电离要吸收能量,用50mL0.1mol•L-1的盐酸分别与60mL0.1mol•L-1NaOH溶液、60mL0.1mol•L-1氨水充分反应,放出热量( )
| A. | 相等 | B. | 前者大于后者 | C. | 后者大于前者 | D. | 无法判断 |

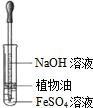

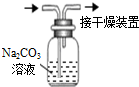
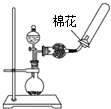
 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL.回答下列问题:
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL.回答下列问题: