题目内容
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:(1)上述实验中发生反应的化学方程式有:CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑.
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V1=30ml,
故答案为:30;10;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(2)小题,首先V1、V6的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.为进一步研究有关因素对反应速率的影响,探究如下.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如表.
实验①②是探究KIO3溶液的浓度或者浓度对反应速率的影响,表中t1>t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成如表中内容.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如表.
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
18.检验实验室配制的FeCl2溶液中的Fe2+是否被氧化生成Fe3+,应选用的最适宜的试剂是( )
| A. | 稀硝酸 | B. | 溴水 | C. | KSCN溶液 | D. | 酸性高锰酸钾 |
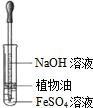

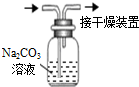
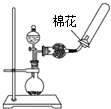
 化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多.
化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多. 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL.回答下列问题:
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL.回答下列问题: