题目内容
11.将10mL充满NO2和O2混合气体的试管倒水槽中,反应停止后试管内剩余2mL色气体,求原混合气体中NO2和O2各多少毫升.分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,假定全部为二氧化氮,剩余气体体积为$\frac{1}{3}$×10mL=3.3mL>2mL,说明剩余气体为NO或氧气.
若为氧气,计算参加反应气体总体积,根据4NO2+O2+2H2O=4HNO3计算NO2体积,混合气体总体积减去二氧化氮体积等于原来的氧气体积;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积.
解答 解:可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,假定全部为二氧化氮,剩余气体体积为$\frac{1}{3}$×10mL=3.3mL>2mL,说明剩余气体为NO或氧气.
若为氧气,则参加反应的气体为10mL-2mL=8mL,根据4NO2+O2+2H2O=4HNO3,可知参加此反应的NO2的体积为8ml×$\frac{4}{5}$=6.4mL,原混合气体中O2的体积为10mL-6.4mL=3.6mL;
若剩余气体为NO气体,根据3NO2+H2O=2HNO3+NO,可知过量的NO2为3×2mL=6mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为10mL-6mL=4mL,则反应消耗的氧气为4mL×$\frac{1}{5}$=0.8mL,则混合气体中NO2的体积=10mL-0.8mL=9.2mL,
答:原混合气体中V(NO2)=6.4mL、V(O2)=3.6mL或V(NO2)=9.2mL、V(O2)=0.8mL.
点评 本题考查了氮氧化物的性质、混合物有关计算,难度中等,关键是分析剩余气体的成分,再根据方程式计算.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | 2HCl+Ba(OH)2═BaCl2+2H2O | ||
| C. | H2SO4+Cu(OH)2═CuSO4+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
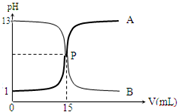
| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时可能未完全反应,溶液呈可能呈酸性也可能呈碱性 | |
| C. | 曲线A是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |