题目内容
3.如图曲线A和B是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )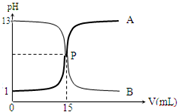
| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时可能未完全反应,溶液呈可能呈酸性也可能呈碱性 | |
| C. | 曲线A是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
分析 由图可知,曲线B的pH由13变小,则为盐酸滴定NaOH溶液的曲线;曲线A的pH由1变大,则为NaOH溶液滴定盐酸的曲线,指示剂为酚酞或甲基橙,以此来解答.
解答 解:A.从图可以看出氢氧化钠溶液的pH为13,故浓度为0.1 mol•L-1,故A正确;
B.P点为滴定终点,盐酸与氢氧化钠溶液完全反应时溶液显中性,故B错误;
C.曲线A溶液的pH逐渐增大,故是氢氧化钠溶液滴定盐酸的测定曲线,故C错误;
D.强酸强碱之间的滴定可以用甲基橙,也可以用酚酞,故D错误;
故选A.
点评 本题考查酸碱中和滴定曲线,为高频考点,把握起点pH及滴定中pH的变化为解答的关键,侧重分析与实验能力的考查,注意滴定终点与反应终点的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列叙述一定正确的是( )
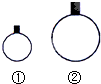

| A. | 常温常压下,相同物质的量的物质,其体积一定相等 | |
| B. | 常温常压下,用等质量的H2、CH4两种气体分别吹出如图所示的两个气球,其中①号气球内气体一定为CH4 | |
| C. | 任何条件下,等物质的量的氮气和一氧化碳所含的分子数、原子数不一定相等 | |
| D. | 1mol金属镁与其他物质发生化学反应,金属镁失去的电子数一定是2NA |
18.某物质溶于水,所得溶液既能使蓝色石蕊试液变红,也能与碳酸盐反应生成气体,此物质可能是①氧化物②盐③碱④单质⑤酸中的( )
| A. | ①⑤ | B. | ①②④⑤ | C. | ② | D. | ①②③④⑤ |
8.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol丙烯酸含有NA个不饱和键 | |
| B. | 标准状况下,11.2L的苯中含有3NA个碳氢键 | |
| C. | 0.1mol/L的Na3PO4溶液中含有的阴离子总数大于0.1NA | |
| D. | 1L1.0mol/L的Na2SiO3溶液中含有的氧原子数目大于3NA |
15.以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有( )


| A. | 1步 | B. | 2步 | C. | 3 | D. | 4步 |
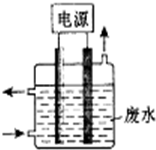
12. 熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )
 熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )| A. | 该电池放电时,负极的反应式为:H2-2e-+CO32-═H2O+CO2 | |
| B. | 该电池中CO32-的为由左边移向右边移动 | |
| C. | 该电池放电时,正极的反应式为:O2+2CO2+4e-═2CO32- | |
| D. | 该电池放电时,当转移4mol e-时正极消耗1mol O2和2mol CO2 |
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右. (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)