题目内容
16.滴定分析中,测定结果的相对误差一般在 左右.( )| A. | 2×10-3 | B. | 2×10-2 | C. | 2×10-1 | D. | 2×10-4 |
分析 滴定分析法是广泛被采用的一种常量分析方法,即被测组分的含量一般在1%以上,有时也可测微量组分,滴定分析所需要的仪器设备简单,易于掌握和操作,测定快速,准确度高,一般情况下测定的相对误差为0.1%左右;
解答 解:滴定分析中,测定结果的相对误差一般在0.1%左右,选项中只有2×10-3 符合,
故选A.
点评 本题考查了滴定实验的准确度和相对误差的理解应用,注意知识的准确性,掌握基础是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最大的是Na,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物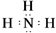 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式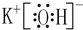 ;
;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物
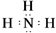 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式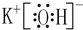 ;
;(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程
 .
.
4.在三个体积为1L、温度保持不变的容器中,分别发生反应3A(g)+B(g)?3C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为2.4mol,下列说法正确的是( )
| 反应前各物质的物质的量/mol | |||
| A | B | C | |
| 甲 | 6 | 2 | 0 |
| 乙 | 0 | 0 | 6 |
| 丙 | 6 | 2 | 6 |
| A. | 带大平衡时,丙中A的溶度是甲中的2倍 | |
| B. | 若反应开始时向容器中加入A为2mol,B为0.5mol,C为3mol,则反应v(正)>v(逆) | |
| C. | 到达平衡时,甲中A的转化率等于乙中C的转化率 | |
| D. | 若保持恒温恒压,达到平衡后再向乙容器中再充入2molC,C的百分含量不变 |
1.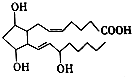 前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
 前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )| A. | PGF2α的分子式为C20H32O5 | |
| B. | 1mol PGF2α能与3molH2发生加成反应 | |
| C. | PGF2α不能使酸性高锰酸钾溶液褪色 | |
| D. | PGF2a在浓硫酸的作用下能发生酯化反应 |
8.下列有机物中,能发生消去反应、酯化反应的是( )
| A. |  | B. | CH3CH2CH2CH2Cl | ||
| C. |  | D. |  |
9.常温下,向10mL0.1mol•L-1的HR溶液中0.1mol•L-1的氨水,下列分析不正确的是( )
| A. | 开始滴加氨水后溶液导电能力逐渐增强,说明HR为弱酸 | |
| B. | 滴入10mL氨水后酸碱恰好中和,此时溶液pH=7 | |
| C. | 随若氨水的加入,当c(OH-)>c(H+)时,c(NH4+)>(R-) | |
| D. | 该过程中溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |