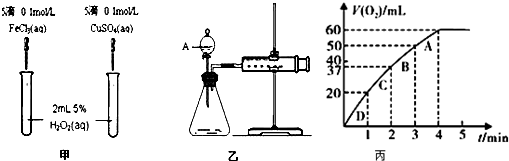
题目内容
11.SO2通入NaOH溶液中也可能发生反应:SO2+2NaOH→Na2SO3+H2O,将一定量SO2通入含6mol NaOH的溶液,完全反应后,再加入过量Na2CO3,加热放出2mol CO2,计算最终生成Na2SO3的质量(写出计算过程).分析 将一定量SO2通入含6mol NaOH的溶液,完全反应后,再加入过量Na2CO3,加热放出2mol CO2,说明是NaO3与Na2CO3反应,则NaOH完全反应,最终S元素全部以Na2SO3形式存在,根据钠离子守恒计算最终生成Na2SO3的物质的量,进而计算其质量.
解答 解:将一定量SO2通入含6mol NaOH的溶液,完全反应后,再加入过量Na2CO3,加热放出2mol CO2,说明是NaO3与Na2CO3反应,则NaOH完全反应,由碳元素守恒可知参加反应的Na2CO3为2mol,最终S元素全部以Na2SO3形式存在,根据钠离子守恒,最终生成n(Na2SO3)=n(Na2CO3)+$\frac{1}{2}$n(NaOH)=2mol+$\frac{1}{2}$×6mol=5mol,其质量为5mol×126g/mol=630g,
答:最终生成Na2SO3的质量为630g.
点评 本题考查混合物有关计算,关键是理解生成二氧化碳的反应判断NaOH完全反应,注意利用守恒法计算解答,较好地考查学生分析计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、H+ | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、I? |
2.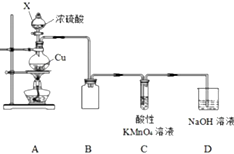 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
实验一:铜与浓硫酸反应
按如图装置进行实验(部分夹持装置略).
(1)仪器X的名称是分液漏斗,装置B的作用是防止倒吸;
(2)组装好仪器,检查装置气密性的操作是手握烧瓶,若C、D导管中有气泡冒出,松开手,C、D中有液柱回流;
(3)装置C中发生反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
实验二:探究产物成分
上述实验后发现烧瓶底部有灰色固体,兴趣小组同学设计实验进一步探究灰色固体的成分.
【查阅资料】
i.铜与浓硫酸反应可能有CuO、Cu2S、CuS等副产物生成.
ii.CuO、Cu2S和CuS均为黑色不溶于水的固体;Cu2S和CuS不溶于稀硫酸,在空气中充分燃烧,均转化为CuO和SO2.
【实验探究】
(4)请完成下表:
 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.实验一:铜与浓硫酸反应
按如图装置进行实验(部分夹持装置略).
(1)仪器X的名称是分液漏斗,装置B的作用是防止倒吸;
(2)组装好仪器,检查装置气密性的操作是手握烧瓶,若C、D导管中有气泡冒出,松开手,C、D中有液柱回流;
(3)装置C中发生反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
实验二:探究产物成分
上述实验后发现烧瓶底部有灰色固体,兴趣小组同学设计实验进一步探究灰色固体的成分.
【查阅资料】
i.铜与浓硫酸反应可能有CuO、Cu2S、CuS等副产物生成.
ii.CuO、Cu2S和CuS均为黑色不溶于水的固体;Cu2S和CuS不溶于稀硫酸,在空气中充分燃烧,均转化为CuO和SO2.
【实验探究】
(4)请完成下表:
| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
19.如表为元素周期表的一部分.
回答下列问题:
(1)Z元素在周期表中的位置为第三周期VⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为-69℃和58℃.写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为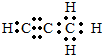 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol•L-1 NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期VⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为-69℃和58℃.写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为
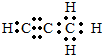 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol•L-1 NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
16.滴定分析中,测定结果的相对误差一般在 左右.( )
| A. | 2×10-3 | B. | 2×10-2 | C. | 2×10-1 | D. | 2×10-4 |
3.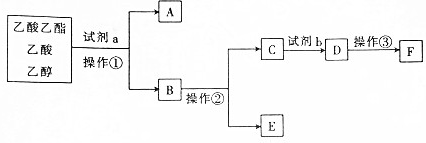
下列说法错误的是( )

下列说法错误的是( )
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
4.在短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 四种元素均可与氢元素形成 18电子分子 | |
| B. | X、Y、Z、W形成的单质最多有 6种 | |
| C. | 四种元素中,Z的最高价氧化物对应水化物酸性最强 | |
| D. | 四种元素的原子半径:rZ>rX>rY>rW |