题目内容
11.关于如图所示转化关系(X代表卤素),说法正确的是( )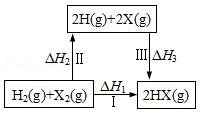
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
分析 A.化学键的断裂要吸热,焓变大于0;
B.依据盖斯定律分析,反应焓变与起始物质和终了物质有关于变化途径无关;
C.HCl、HBr、HI的化学键的键能逐渐减小;
D.氢气的燃烧热必须生成液态水,而该反应生成的是卤化氢.
解答 解:A.化学键的断裂要吸热,焓变大于0,H2(g)+X2(g)═2H(g)+2X(g)△H2>0,故A正确;
B.反应焓变与起始物质和终了物质有关于变化途径无关,途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 ,故B错误;
C.途径III是断形成化学键的过程,是放热过程,Cl、Br、I的原子半径依次增大,故形成HCl、HBr、HI化学键所放出的能量逐渐减小,故C错误;
D.反应Ⅰ为氢气与卤素单质的化合反应,不是氢气与氧气反应,所以△H1不是H2的燃烧热,故D错误;
故选A.
点评 本题考查了反应热与焓变,题目难度不大,明确盖斯定律的内容为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.X、Y、Z、W、R属于短周期元素,已知它们都不是稀有气体元素,X原子半径是所属周期中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述中,错误的是( )
| A. | Y的最简单氢化物比R的稳定,Y的最简单氢化物沸点比R的高 | |
| B. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y与Z两种元素组成常见ZY2型分子 |
19.氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
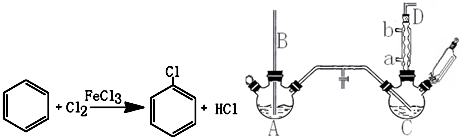
已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号).
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
则1t苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式).

已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号).
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
16. 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )| A. | 在其他条件不变时,途径Ⅰ与途径Ⅱ中乙醛的转化率相同 | |
| B. | 途径Ⅱ是加入催化剂时能量变化曲线,且催化剂是I2 | |
| C. | 途径Ⅰ与途径Ⅱ的焓变(△H)相同 | |
| D. | 加入催化剂将增大正反应速率,降低逆反应速率 |
3.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2?2H2O的流程如图所示:
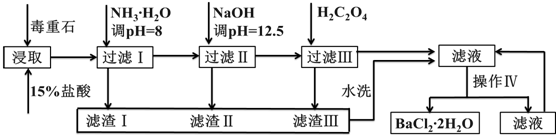
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)实验室用37%的盐酸配制1mol/L盐酸,除烧杯外,还需要使用下列玻璃仪器中的:abc.
a.容量瓶 b.量筒 c.玻璃棒 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有:研磨成粉、加热、搅拌等.(至少两条)
(2)加入氨水调节溶液pH=8的目的是:使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是:H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
氯化钡溶液浓度为$\frac{({V}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将偏大(填“偏大”或“偏小”).

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
(1)实验室用37%的盐酸配制1mol/L盐酸,除烧杯外,还需要使用下列玻璃仪器中的:abc.
a.容量瓶 b.量筒 c.玻璃棒 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有:研磨成粉、加热、搅拌等.(至少两条)
(2)加入氨水调节溶液pH=8的目的是:使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是:H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
氯化钡溶液浓度为$\frac{({V}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将偏大(填“偏大”或“偏小”).
20.两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:2,则Na2CO3和HCl溶液的浓度之比为( )
| A. | 3:2 | B. | 2:5 | C. | 3:4 | D. | 4:3 |
1.下列说法正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 硝酸铵溶于水温度降低,这个过程吸热热量 | |
| C. | 同温同压下,H2和Cl2在光照和点燃条件下的△H不同 | |
| D. | 自发反应的熵一定增大,非自发反应的熵一定减小 |

 200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)
200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)