题目内容
16. 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )| A. | 在其他条件不变时,途径Ⅰ与途径Ⅱ中乙醛的转化率相同 | |
| B. | 途径Ⅱ是加入催化剂时能量变化曲线,且催化剂是I2 | |
| C. | 途径Ⅰ与途径Ⅱ的焓变(△H)相同 | |
| D. | 加入催化剂将增大正反应速率,降低逆反应速率 |
分析 途径Ⅰ与途径Ⅱ相比较,途径Ⅱ能量较低,应加入催化剂,催化剂降低反应的活化能,但平衡不发生移动,反应的焓变不变,同等程度增大反应速率,以此解答该题.
解答 解:A.途径Ⅰ与途径Ⅱ反应物和生成物相同,为加入催化剂的影响,平衡不移动,转化率相等,故A正确;
B.途径Ⅱ加入催化剂,反应中碘为催化剂,反应前后的质量、性质不变,故B正确;
C途径Ⅰ与途径Ⅱ反应物和生成物相同,则焓变相等,故C正确;
D.催化剂同等程度改变反应速率,故D错误.
故选D.
点评 本题综合考查反应热与焓变、催化剂对平衡移动的影响等知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握图象的分析以及平衡移动的催化剂对化学平衡的影响,难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
20.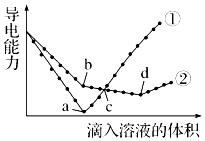 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
7.碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等. 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:
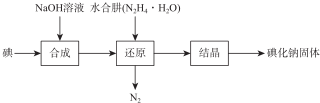
已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为2Fe3++2I-═2Fe2++I2.
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.

已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.
4.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低.某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
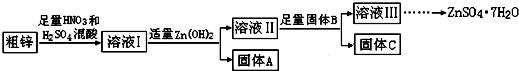
请回答下列问题:
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是除去溶液Ⅱ中的Cu2+.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.

| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是除去溶液Ⅱ中的Cu2+.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
11.关于如图所示转化关系(X代表卤素),说法正确的是( )
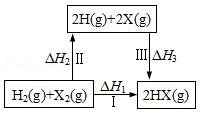

| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
1.如图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是( )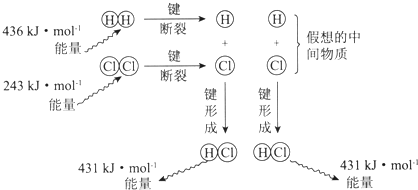

| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
5.实验室需配制480mL 0.1mol•L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.