题目内容
3.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2?2H2O的流程如图所示: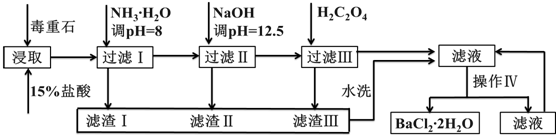
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
(1)实验室用37%的盐酸配制1mol/L盐酸,除烧杯外,还需要使用下列玻璃仪器中的:abc.
a.容量瓶 b.量筒 c.玻璃棒 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有:研磨成粉、加热、搅拌等.(至少两条)
(2)加入氨水调节溶液pH=8的目的是:使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是:H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
氯化钡溶液浓度为$\frac{({V}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将偏大(填“偏大”或“偏小”).
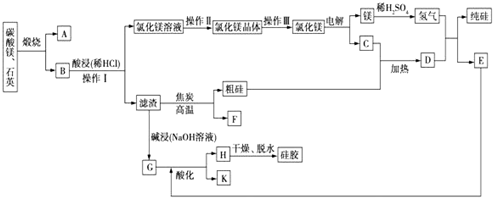
分析 制备BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl2•2H2O,
(1)实验室用37%的盐酸配置15%的盐酸,需量取浓盐酸的体积和水的体积,且需使用烧杯作为容器稀释,玻璃棒搅拌;为了加快毒重石的酸浸速率,可以研磨成粉、加热、搅拌,增大反应速率;
(2)根据流程图和表中数据分析加入NH3•H2O调节pH=8可除去Fe3+,加入NaOH调pH=12.5,可完全除去Mg2+,除去部分Ca2+,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入过量H2C2O4,易发生Ba2++H2C2O4═BaC2O4↓+2H+,产品的产量减少;
(3)操作Ⅳ是从氯化钡溶液中获得氯化钡晶体,可以通过蒸发浓缩、冷却结晶、过滤得到;
(4)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行,根据Ba2++CrO42-═BaCrO4↓、2CrO42-+2H+═Cr2O72-+H20,与Ba2+反应的CrO42-的物质的量为总盐酸的物质的量减去过量的盐酸,分局BaCl2溶液的浓度计算公式,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大.
解答 解:(1)实验室用37%的盐酸配置15%的盐酸,需量取浓盐酸的体积和水的体积,所以要用量筒,且需使用烧杯作为容器稀释,玻璃棒搅拌,故选abc,为了加快毒重石的酸浸速率,可以研磨成粉、加热、搅拌等,增大反应速率,
故答案为:abc;研磨成粉、加热、搅拌等;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,
故答案为:使Fe3+形成Fe(OH)3沉淀而除去;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少;
(3)操作Ⅳ是从氯化钡溶液中获得氯化钡晶体,可以通过蒸发浓缩、冷却结晶、过滤得到,
故答案为:过滤;
(4)步骤Ⅱ:待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H20 的盐酸的物质的量为:V1×10-3×bmol,步骤Ⅰ:用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:$\frac{({V}_{0}-{V}_{1})b×1{0}^{-3}}{y×1{0}^{-3}}$mol/L=$\frac{({V}_{0}-{V}_{1})b}{y}$mol/L,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大,
故答案为:$\frac{({V}_{0}-{V}_{1})b}{y}$;偏大.
点评 本题考查了实验室利用毒重石制备BaCl2•2H2O的设计方法,侧重考查影响反应速率的因素、实验基本操作、沉淀溶解平衡的应用等知识,实验步骤结合物质的性质分析是解答的关键,题目难度中等.

| A. | 足量铁在氯气中反应,1mol铁失去的电子数为3NA | |
| B. | 6.4g Cu与足量硫充分反应后,转移电子数为0.2NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应后,产物的分子数为NA | |
| D. | 常温常压下,0.1mol NH3与0.1mol HCl充分反应后所得产物含0.1NA个分子 |
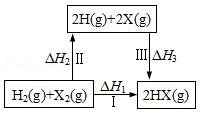
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
| A. | 铁在潮湿空气中生锈是自发过程 | B. | 有些放热反应常温下是非自发的 | ||
| C. | 自发反应都是熵增大的反应 | D. | 电解池的反应不都是非自发反应 |
(1)配制500mL 0.1mol/L 的盐酸
| 应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
A用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B 用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌,使其混合均匀
C 将已冷却的溶液沿玻璃棒注入所选容量瓶中
D 盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)操作A中,将洗涤液都注入容量瓶,其目的是保证溶质全部转入容量瓶中,若无操作A,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”),应如何处理重新配制.
| A. | Ba2+、Cl-、NO3-、K+ | B. | HCO3-、K+、SO42-、Cl- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | Na+、Cl-、K+、SO42-、 |