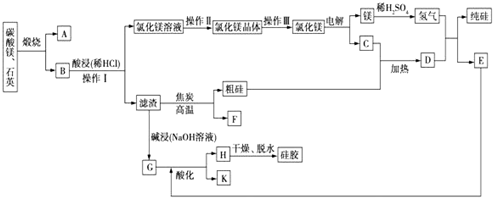
题目内容
19.氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: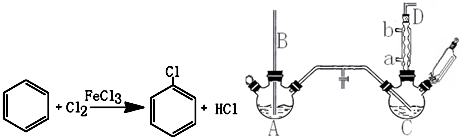
已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号).
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
分析 (1)玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;采取逆流原理通入冷凝水;
(2)①反应器C加热控制反应温度在40-60℃,应利用水浴加热;
②由于苯易挥发,反应产生的HCl,且有未反应的氯气,都会在D出口导出;
(3)催化剂氯化铁与氢氧化钠反应,生成的HCl会与氢氧化钠反应,溶解的氯气也会与去氧化钠反应;
(4)A、C反应器之间需要增添干燥装置,干燥生成的氯气,可以用五氧化二磷或氯化钙等;
(5)根据苯的总流失量计算参加反应的苯的质量,再根据苯与氯苯质量定比关系计算.
解答 解:(1)玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;采取逆流原理通入冷凝水,使冷凝管充满冷凝水,充分冷却,即冷凝水由a口流入,由b口流出,
故答案为:平衡气压;a;
(2)①反应器C加热控制反应温度在40-60℃,应利用水浴加热,故选:c,
故答案为:c;
②由于苯易挥发,反应产生的HCl,且有未反应的氯气,D出口气体中含有HCl、苯蒸汽、氯气,
故答案为:苯蒸汽、氯气;
(3)②催化剂氯化铁与氢氧化钠反应,生成HCl会与氢氧化钠反应,溶解的氯气也会与去氧化钠反应,反应方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O;
(4)A、C反应器之间需要增添U型管,干燥生成的氯气,可以用五氧化二磷或氯化钙等,
故答案为:五氧化二磷或氯化钙;
(5)苯的总流失量为89.2kg/t,故1t苯中参加反应的苯的质量为(1t-0.0892t),由苯与氯苯质量之比为78:112.5,可知生成氯苯质量为$\frac{(1-0.0892)×112.5}{78}$t,
故答案为:$\frac{(1-0.0892)×112.5}{78}$.
点评 本题考查有机物制备实验方案,涉及对装置、操作与原理的分析评价、化学计算等知识,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握制备方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
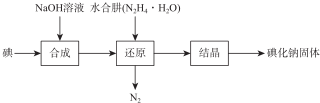
已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
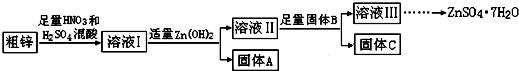
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是除去溶液Ⅱ中的Cu2+.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
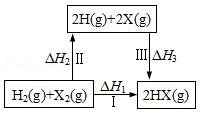
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |