题目内容
18.完成以下四个小题:(1)请完成下列各空:
①0.01mol/LCH3COOH溶液的pH>2(填“>”或“<”)
②0.1mol/LCH3COONa溶液的pH>7(填“>”或“<”)
(2)观察比较以上二个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是:证明HA不能完全电离,溶液中存在电离平衡;
二是:证明HA与强碱生成得盐具有弱碱性.
(3)请你根据以上原理提出写两种不同方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤)
①对比等物质的量浓度的HA溶液和盐酸导电性对比实验
②测0.01mol/LHAc溶液的pH>2
(4)某同学设计采用如下方案来证明HA是弱电解质:
①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的稀释液,同时加入纯度和大小相同的锌粒,如观察到HA溶液中产生H2速率较快的,即可证明HA是弱电解质
请你评价:该同学的方案难以实现之处和不妥之处,并且重新审视你提出的方案中哪些是不合理的:配制pH=1的HA溶液难以实现;不妥之处在于加入的锌粒难以做到表面积相同.
分析 (1)①CH3COOH是弱酸,在水溶液中部分电离;
②CH3COONa属于强碱弱酸盐,弱酸根离子在水溶液中水解显碱性;
(2)在水溶液里和熔融状态下部分电离的电解质是弱电解质,弱电解质中存在电离平衡;
(3)证明某酸(HA)是弱电解质的两种方案是测定酸的pH或其盐溶液的pH;
(4)根据配制pH=1的弱电解质HA的溶液难以实现及“纯度和大小相同的锌粒”不妥分析.
解答 解:(1)①CH3COOH是弱酸,在水溶液中部分电离,所以溶液中氢离子浓度小于酸的浓度,所以0.01mol/L CH3COOH溶液的pH>2,
故答案为:>;
②CH3COONa属于强碱弱酸盐,醋酸根离子在水溶液中水解CH3COO-+H2O?CH3COOH+OH-,显碱性,所以溶液的pH>7,
故答案为:>;
(2)根据弱电解质在水溶液里存在电离平衡可知,证明某酸(HA)属于弱电解质,可证明溶液中存在电离平衡,或证明HA与强碱生成盐的溶液具有碱性,
故答案为:证明HA不能完全电离,溶液中存在电离平衡;证明HA与强碱生成得盐具有弱碱性;
(3)证明某酸(HA)是弱电解质的两种方案有:故答案为:①对比等物质的量浓度的HA溶液和盐酸导电性对比实验;②测0.01mol/LHAc溶液的pH>2;③测NaAc溶液的pH值;④测pH=a的HAc稀释100倍后所得溶液pH<a+2;⑤将物质的量浓度相同的HAc溶液和NaOH溶液等体积混合后溶液呈碱性;⑥中和10mLpH=1的HAc溶液消耗pH=13的NaOH溶液的体积大于10mL;⑦将pH=1的HAc溶液与pH=13的NaOH溶液等体积混合后溶液呈酸性;⑧比较物质的量浓度相同的HAc溶液与盐酸分别与同样的锌粒反应产生气体的速率,
故答案为:①对比等物质的量浓度的HA溶液和盐酸导电性对比实验;②测0.01mol/LHAc溶液的pH>2(或③测NaAc溶液的pH值;④测pH=a的HAc稀释100倍后所得溶液pH<a+2;⑤将物质的量浓度相同的HAc溶液和NaOH溶液等体积混合后溶液呈碱性;⑥中和10mLpH=1的HAc溶液消耗pH=13的NaOH溶液的体积大于10mL;⑦将pH=1的HAc溶液与pH=13的NaOH溶液等体积混合后溶液呈酸性;⑧比较物质的量浓度相同的HAc溶液与盐酸分别与同样的锌粒反应产生气体的速率);
(4)弱酸在稀释过程中会继续电离出氢离子,所以配制pH=1的HA溶液难以实现;
又因为固体的表面积也影响反应速率,因此不妥之处在于加入的锌粒表面积难以做到相同,
故答案为:配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒表面积难以做到相同.
点评 本题考查了比较酸性强弱的方法,高考中的常见题型,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,该题有利于培养学生严谨的逻辑思维能力,以及语音组织和表达能力,提高学生的学习效率,激发学生的学习兴趣.

 阅读快车系列答案
阅读快车系列答案| A. | 维生素A: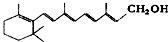 它是一种难溶于水的醇 它是一种难溶于水的醇 | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2 | |
| D. | 金属材料都是导体,非金属材料不都是绝缘体 |
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 标准状况下,1mol物质的体积为22.4L | |
| C. | H2、O2、N2、CO2组成的混合气体1mol在标准状况下的体积约为22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
| A. | pH均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
| A. | 0.5mol的K+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 1.0mol的OH- |
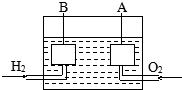 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.