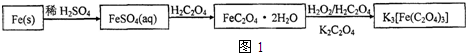
题目内容
6.(1)写出O元素的简单离子结构示意图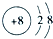
(2)S元素在周期表中的位置第三周期第ⅥA族,S元素与周期表中原子半径最小的元素形成18电子化合物的电子式
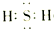
(3)写出SO2与双氧水、氯化钡反应的离子方程式H2O2+SO2+Ba2+=BaSO4+2H+.
分析 (1)氧离子核内有8个质子,核外有两个电子层,分别容纳2,8个电子;
(2)硫有3个电子层,最外层有6个电子;与两个氢原子分别共用1对电子形成硫化氢;
(3)二氧化硫能够被双氧水氧化生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀.
解答 解:(1)氧离子核内有8个质子,核外有两个电子层,分别容纳2,8个电子,离子结构示意图: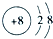 ,故答案为:
,故答案为: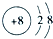 ;
;
(2)硫有3个电子层,最外层有6个电子,在周期表中:第三周期第ⅥA族;与两个氢原子分别共用1对电子形成硫化氢,电子式为: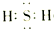 ;
;
故答案为:第三周期第ⅥA族;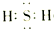 ;
;
(3)二氧化硫能够被双氧水氧化生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,离子方程式:H2O2+SO2+Ba2+=BaSO4+2H+;
故答案为:H2O2+SO2+Ba2+=BaSO4+2H+.
点评 本题考查了原子结构与元素周期表之间关系,原子结构示意图画法,离子方程式的书写,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列化学反应的离子方程式错误的是( )
| A. | Al(OH)3与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | Al2O3溶于过量NaOH溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 铁溶于稀H2SO4中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Al(OH)3溶于NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O |
17.下列反应的离子方程式正确的是( )
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
1.下列说法正确的是( )
| A. | 按系统命名法,CH3CH(C2H5)CH(C2H5)CH3的名称是2,3-二乙基丁烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 通过石油裂解可以得到乙烯、丙烯、甲烷、苯、甲苯等重要化工基本原料 | |
| D. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 |
15.将SO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是( )
| A. | 氯化钾溶液 | B. | 碳酸氢钙溶液 | C. | 氯水 | D. | 氢氧化钠溶液 |