题目内容
5.某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图.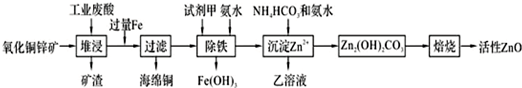
已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”、“<”或“=”).
(2)除铁过程中试剂甲最好选用B(填序号).
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在3.2~6.2范围之间.
(4)试写出沉淀Zn2+时发生反应的离子方程式:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.
分析 氧化铜锌矿先用稀硫酸溶解,然后过滤分离出矿渣,向所得溶液中加入过量Fe将Cu铜置换出来,得到海绵铜,向滤液中加入试剂甲、氨水除去铁,加氧化剂将Fe2+氧化成Fe3+,加氨水调节溶液的pH,过滤将其除去,再用NH4HCO3洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到ZnO,乙的溶液可直接用作氮肥,乙溶液为(NH4)2SO4,以此解答该题.
解答 解:氧化铜锌矿先用稀硫酸溶解,然后过滤分离出矿渣,向所得溶液中加入过量Fe将Cu铜置换出来,得到海绵铜,向滤液中加入试剂甲、氨水除去铁,加氧化剂将Fe2+氧化成Fe3+,加氨水调节溶液的pH,过滤将其除去,再用NH4HCO3洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到ZnO,乙的溶液可直接用作氮肥,乙溶液为(NH4)2SO4,
(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<;
(2)除铁过程中,要将亚铁离子转化为铁离子,然后用氨水除去铁离子,试剂甲具有氧化性且不能引进新的杂质,高锰酸钾、硝酸、氯气都具有强氧化性但能引进新的杂质,所以应该选取双氧水,双氧水被还原生成水,故答案为:B;
(3)从图表数据可知,铁离子沉淀完全的pH为3.2,锌离子开始沉淀的pH为6.2.故除铁pH范围为:3.2~6.2,故答案为:3.2~6.2;
(4)硫酸锌、碳酸氢铵和一水合氨反应生成碱式碳酸锌和硫酸铵、水,反应的离子方程式为2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O,
故答案为:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生知识综合应用能力,明确物质性质及物质分离和提纯方法是解本题关键,难点是计算铁离子浓度,知道流程图中各部分可能发生的反应、采用的分离方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 氢氧化钡溶液与硫酸的反应:OH-+H+═H2O | |
| B. | 向澄清的石灰水中通入过量的CO2:OH-+CO2═HCO3- | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 金属钠与硫酸铜反应:2Na+Cu2+═2Na++Cu |
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-241.6kJ•mol-
③CO(g)+O2(g)═CO2(g)△H3=-283.0kJ•mol-1
④H2O(g)═H2O(l)△H4=-44kJ•mol-1
下列说法合理的是( )
| A. | 氢气的燃烧热△H=-241.6 kJ•mol-1 | |
| B. | 等质量的H2、CO完全燃烧时,CO释放的热量更多 | |
| C. | 煤的气化的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=-131.1 kJ•mol-1 | |
| D. | 煤炭完全燃烧释放1967.5 kJ热量时转移20 mol电子 |
| A. | 该反应在40 min内的平均速率可表示为 ν(NH3)=0.001 mol/L•min | |
| B. | 该反应达到平衡时,保持其他条件不变,容器中NH3、N2、H2的物质的量保持相等 | |
| C. | 其他条件不变,升高温度,可使该反应的速率加快 | |
| D. | 达到平衡时,ν(NH3)=ν(N2) |
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2 2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- | |
| D. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
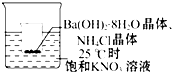 把小烧杯放入25℃的盛有饱和硝酸钾溶液的大烧杯中,小烧杯(已被设法固定)中放有 25g研成粉末的氢氧化钡晶体[Ba(OH)2•8H2O],再加入约12g的氯化铵晶体,并搅拌使其充分反应.
把小烧杯放入25℃的盛有饱和硝酸钾溶液的大烧杯中,小烧杯(已被设法固定)中放有 25g研成粉末的氢氧化钡晶体[Ba(OH)2•8H2O],再加入约12g的氯化铵晶体,并搅拌使其充分反应.