题目内容
13.镁及其化合物有着广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如图1: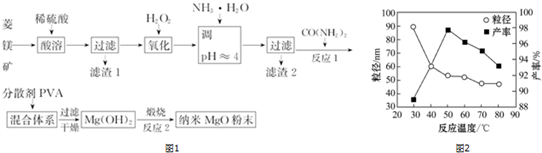
(1)滤渣1为SiO2.
(2)加入H2O2氧化时,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在实验室煅烧滤渣2制得的金属氧化物为Fe2O3(填化学式),需要的仪器除酒精灯、三脚架、泥三角以外,还需要坩埚(填名称).
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应中反应物的质量之比为10:9.
(5)25℃时,加入CO(NH2)2至开始产生沉淀,当Mg2+全部沉淀时溶液的c(OH-)=1.4×10-3 mol•L-1(已知25℃,
Ksp[Mg(OH)2]=1.96×10-11).
(6)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米MgO.取少量制得的该物质溶于某种液体溶剂中(两者不反应),能说明是纳米MgO存在的简单方法是用一束光照射,在侧面会看到一条光亮的通路.
如图2为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为50℃.
分析 菱铁矿(主要成分为MgCO3,含少量FeCO3、SiO2)加入稀硫酸酸溶,二氧化硅不反应,过滤分离,滤渣1为SiO2,过滤得到滤液中含有硫酸镁、硫酸亚铁、未反应的硫酸,滤液中加入过氧化氢,将Fe2+氧化为Fe3+,则加入一水合氨调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液中含有硫酸镁、硫酸铵等,加入CO(NH2)2始产生沉淀,加入PVA进行分散,过滤干燥得到氢氧化镁沉淀,高温煅烧制备纳米氧化镁,
(1)二氧化硅不与硫酸反应;
(2)酸性条件下,H2O2将Fe2+氧化为Fe3+;
(3)滤渣2为氢氧化铁,氢氧化铁煅烧分解生成的氧化铁,灼烧固体需要在坩埚中进行;
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,根据原子守恒可知弱碱为一水合氨;
(5)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.96×10-11计算;
(6)利用丁达尔现象可鉴别胶体,根据图,选择产率高、粒径小的温度.
解答 解:(1)二氧化硅不与硫酸反应,滤渣1为SiO2,
故答案为:SiO2;
(2)酸性条件下,H2O2将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)滤渣2为氢氧化铁制,煅烧氢氧化铁分解生成的氧化铁,化学式为Fe2O3,灼烧固体需要在坩埚中灼烧,
故答案为:Fe2O3;坩埚;
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨,反应的化学方程式为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O,所以该反应中反应物CO(NH2)2与H2O物质的量之比为1:3,则质量之比为1×60:3×18=10:9,
故答案为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O;10:9;
(5)当 Mg2+沉淀完全时,溶液中c(Mg2+)=1.0×10-5 mol•L-1,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.96×10-11,可知c(OH-)=1.4×10-3 mol•L-1,
故答案为:1.4×10-3 mol•L-1;
(6)利用丁达尔现象可鉴别胶体,所以能说明是纳米MgO存在的简单方法是用一束光照射,在侧面会看到一条光亮的通路,图1为反应温度对纳米MgO产率和粒径的影响,50℃时氧化镁产率最大,粒径较小,温度再高,产率减小,粒径变化不大,故反应的最佳温度为50℃,
故答案为:用一束光照射,在侧面会看到一条光亮的通路;50℃.
点评 本题考查物质准备工艺流程,涉及条件的控制与选择、对操作的分析评价、胶体的性质等,注意掌握元素化合物性质,是对学生综合能力的考查,是高考常见题型.

| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、 柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80%生产日期标于包装袋封口上 |
蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中用“盐析”、“变性”或“颜色反应”表述的蛋白质性质填空.
| 实例 | 性质 |
| 紫外线消毒 | 变性 |
| 蛋白质遇浓硝酸变黄 | |
| 误食了重金属离子,可以立即喝大量的牛奶来缓解 毒性 | |
| 鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
| 常用酒精清洗伤口 | |
| 蒸煮鸡蛋食用 |
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
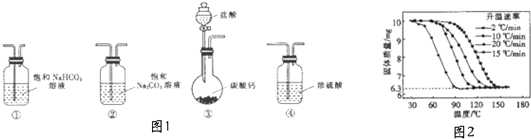
(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定PH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCL2溶液等
体积混合进行实验,结果如下.
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如图2.请填空:
(Ⅰ)样品的纯度为100%.
(Ⅱ)升温速率对实验结果没有(填“有较大”、“有较小”或“没有”)影响.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)═CO(g)+H2(g)△H>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是AD.
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
(3)把水煤气中的混合气体经过处理后获得的较纯H2用于工业合成氨.已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530.0kJ/mol
①氢气的燃烧热△H=-285.8kJ/mol.
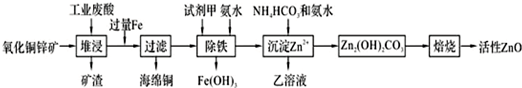
已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”、“<”或“=”).
(2)除铁过程中试剂甲最好选用B(填序号).
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在3.2~6.2范围之间.
(4)试写出沉淀Zn2+时发生反应的离子方程式:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.
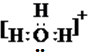 和
和 ;
;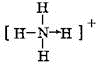 和O=C=O.
和O=C=O.