��Ŀ����
17��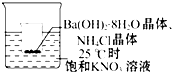 ��С�ձ�����25���ʢ�б����������Һ�Ĵ��ձ��У�С�ձ����ѱ��跨�̶����з��� 25g�гɷ�ĩ��������������[Ba��OH��2•8H2O]���ټ���Լ12g���Ȼ�茶��壬������ʹ���ַ�Ӧ��
��С�ձ�����25���ʢ�б����������Һ�Ĵ��ձ��У�С�ձ����ѱ��跨�̶����з��� 25g�гɷ�ĩ��������������[Ba��OH��2•8H2O]���ټ���Լ12g���Ȼ�茶��壬������ʹ���ַ�Ӧ����1���۲쵽�������ǣ�KNO3��Һ���о���������
��2���������������ԭ����Ba��OH��2•8H2O��NH4Cl���巴Ӧ���ȣ�ʹ��Һ�¶Ƚ��ͣ�KNO3�ܽ�ȼ�С�����¾���������
��3����ʵ����֪����Ӧ�������������Ȼ�淋�������С�ڣ�����ڡ�����С�ڡ����ڡ������������������
��4����ٳ������仯�������������Ȼ�立�Ӧ��ͬ��������ͬ���͵ķ�ӦHCl+NaOH=NaCl+H2O��Zn+H2SO4=ZnSO4+H2����CH4+2O2$\stackrel{��ȼ}{��}$CO2+2H2O�����û�ѧ����ʽ��ʾ��
���� Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ���ȣ�����ʹ�����������Һ���¶Ƚ��ͣ�������ص��ܽ�������¶ȵĽ��Ͷ���С���ʻ�������ؾ����������ݴ˷�����
��� �⣺Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ���ȣ�����ʹ�����������Һ���¶Ƚ��ͣ�������ص��ܽ�������¶ȵĽ��Ͷ���С���ʻ�������ؾ���������
��1������ص��ܽ�������¶ȵĽ��Ͷ���С���ʱ����������Һ�л��о����������ʴ�Ϊ��KNO3��Һ���о���������
��2���������������ԭ����Ba��OH��2•8H2O��NH4Cl���巴Ӧ���ȣ�ʹ��Һ�¶Ƚ��ͣ�KNO3�ܽ�ȼ�С�����¾����������ʴ�Ϊ��Ba��OH��2•8H2O��NH4Cl���巴Ӧ���ȣ�ʹ��Һ�¶Ƚ��ͣ�KNO3�ܽ�ȼ�С�����¾���������
��3��Ba��OH��2•8H2O��NH4Cl���巴Ӧ���ȣ��ʷ�Ӧ���������С������������������ʴ�Ϊ��С�ڣ�
��4��Ba��OH��2•8H2O��NH4Cl���巴Ӧ���ȣ��������仯�������������Ȼ�立�Ӧ��ͬ�ķ�Ӧ��Ϊ���ȷ�Ӧ����Ҫ����������ͬ���͵ķ�Ӧ����HCl+NaOH=NaCl+H2OΪ���ȷ�Ӧ��Ϊ���ֽⷴӦ�� Zn+H2SO4=ZnSO4+H2��Ϊ���ȷ�Ӧ����Ϊ�û���Ӧ��CH4+2O2$\stackrel{��ȼ}{��}$CO2+2H2OΪ���ȷ�Ӧ��Ϊ������ԭ��Ӧ��
�ʴ�Ϊ��HCl+NaOH=NaCl+H2O��Zn+H2SO4=ZnSO4+H2����CH4+2O2$\stackrel{��ȼ}{��}$CO2+2H2O��
���� ���⿼�����ȷ�Ӧ��̽������Ŀ�ѶȲ�����ע������Ȼ�狀�����������Ӧ��ԭ����ע��ӷ�Ӧ�����������������Ĺ�ϵ������

���ܶȱȿ����Ĵ� ����Һ�� ��������ˮ ���ж���
| A�� | �٢� | B�� | �٢� | C�� | �ۢ� | D�� | �٢ۢ� |
��1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��C��s��+H2O��g���TCO��g��+H2��g����H��0�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ���������H2O��g����ƽ��ת���ʵ���AD��
A�������¶� B������̼������ C��������� D����CO���ռ���ȥCO
��2����һ������CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2.0L�ĺ����ܱ������У��������·�Ӧ��
CO��g��+H2O��g���TCO2��g��+H2��g�����õ��������ݣ�
| �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
��3����ˮú���еĻ�����徭���������õĽϴ�H2���ڹ�ҵ�ϳɰ�����֪��
N2��g��+3H2��g���T2NH3��g����H=-92.4kJ��mol-1
2N2��g��+6H2O��l���T4NH3��g��+3O2��g����H=+1530.0kJ/mol
��������ȼ���ȡ�H=-285.8kJ/mol��
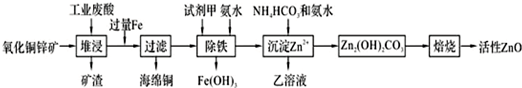
��֪��298Kʱ�����ӿ�ʼ��������ȫ����ʱ��pH�����ʾ��
| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
��1����H2SO4�����¿�ʯ�к��е�ZnS�ܽ��CuS���ܣ�����������ͬ�¶��£�Ksp��CuS����Ksp��ZnS����ѡ���������������=������
��2�������������Լ������ѡ��B������ţ���
A��KMnO4 B��H2O2 C��HNO3 D��Cl2
��3�����������м��백ˮ��Ŀ���ǵ���pH��3.2��6.2��Χ֮�䣮
��4����д������Zn2+ʱ������Ӧ�����ӷ���ʽ��2Zn2++3NH3?H2O+HCO3-=Zn2��OH��2CO3��+3NH4++H2O��
| A�� | 150 mL | B�� | 200 mL | C�� | 250 mL | D�� | ��ȷ�� |
| A�� | ú��������Ϊ����ȼ�ϵĹ������������仯 | |
| B�� | ���ۡ���֬�͵����ʶ��Ǹ߷��ӻ����� | |
| C�� | ������Ҵ����ܷ���ȡ����Ӧ | |
| D�� | ����������ֲ���;���ˮ�������Ҵ� |
������ѹǿ �ڽ���ѹǿ ��ͨ��SO2 �����ӵ�O2�� �������¶� �����¶ȣ�
| A�� | �٢ڢۢ� | B�� | �ڢۢܢ� | C�� | �ڢۢܢ� | D�� | �٢ۢܢ� |
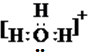 ��
�� ��
��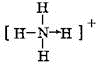 ��O=C=O��
��O=C=O��