题目内容
10.在450℃以V2O5作催化剂时进行如下反应:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
①反应450℃时的平衡常数>500℃时的平衡常数(填“>”、“<”或“=”);
②下列描述中一定能说明上述反应已达平衡的是BD
A.v(O2)正=2v(SO3)逆
B.容器中气体的平均相对分子质量不再变
C.容器中气体的密度不再变
D.容器中气体的分子总数不再变.
分析 (1)化学反应是放热反应,升温,平衡逆向进行,平衡常数减小;
(2)化学平衡的标志是正逆反应速率相同,各组分含量保持不变,“变量不变”据此分析;
解答 解:(1)2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1,反应是放热反应,升温平衡逆向进行,平衡常数减小,所以该反应450℃时的平衡常数大于该反应500℃时的平衡常数,
故答案为:>;
(2)化学平衡的标志是正逆反应速率相同,各组分含量保持不变;
A.速率之比等于化学方程式计量数之比,当2v(O2)正=v(SO3)逆,说明三氧化硫正逆反应速率相同,但选项中速率之比错误,故A不符合;
B.反应前后气体质量不变,但反应前后物质的量在变,则平均相对分子质量在反应过程中一直在变,所以容器中气体的平均相对分子质量不再变能说明反应达到平衡状态,故B符合;
C.反应前后气体质量不变,容器体积不变,密度在反应过程中和平衡状态都不变,容器中混合气体的密度保持不变不能说明费用达到平衡状态,故C不符合;
D.反应前后物质的量在变,则容器中气体的分子总数在反应过程中一直在变,所以容器中气体的分子总数不再变能说明反应达到平衡状态,故D符合;
故答案为:BD,
点评 本题考查了化学平衡平衡常数及其平衡状态的判断,掌握化学平衡的标志是正逆反应速率相同,各组分含量保持不变是关键,题目难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
1.可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质( )
①密度比空气的大 ②易液化 ③能溶于水 ④有毒.
①密度比空气的大 ②易液化 ③能溶于水 ④有毒.
| A. | ①④ | B. | ①② | C. | ③④ | D. | ①③④ |
18.下列物质属于电解质的是( )
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
5.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
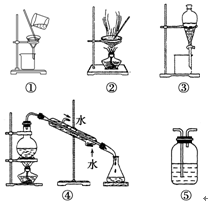
1.某学习小组利用如图1装置进行CO2与饱和NaCO3溶液反应制备NaHCO3实验
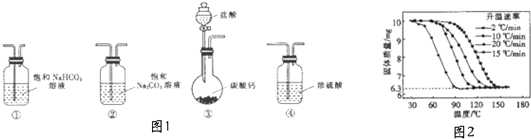
(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定PH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCL2溶液等
体积混合进行实验,结果如下.
(Ⅰ)此实验巳可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.答:Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.[已知:0.1mol•L-1NaHC03溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如图2.请填空:
(Ⅰ)样品的纯度为100%.
(Ⅱ)升温速率对实验结果没有(填“有较大”、“有较小”或“没有”)影响.

(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定PH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCL2溶液等
体积混合进行实验,结果如下.
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如图2.请填空:
(Ⅰ)样品的纯度为100%.
(Ⅱ)升温速率对实验结果没有(填“有较大”、“有较小”或“没有”)影响.
8.碳及其化合物有广泛的用途.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)═CO(g)+H2(g)△H>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是AD.
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
通过计算求出该反应的平衡常数(计算结果保留两位有效数字).
(3)把水煤气中的混合气体经过处理后获得的较纯H2用于工业合成氨.已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530.0kJ/mol
①氢气的燃烧热△H=-285.8kJ/mol.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)═CO(g)+H2(g)△H>0,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O(g)的平衡转化率的是AD.
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
(3)把水煤气中的混合气体经过处理后获得的较纯H2用于工业合成氨.已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530.0kJ/mol
①氢气的燃烧热△H=-285.8kJ/mol.
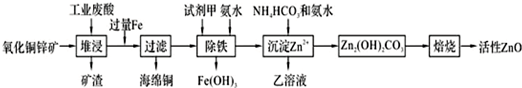
5.某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图.
已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”、“<”或“=”).
(2)除铁过程中试剂甲最好选用B(填序号).
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在3.2~6.2范围之间.
(4)试写出沉淀Zn2+时发生反应的离子方程式:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.

已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”、“<”或“=”).
(2)除铁过程中试剂甲最好选用B(填序号).
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在3.2~6.2范围之间.
(4)试写出沉淀Zn2+时发生反应的离子方程式:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.
6.一定条件下反应:2SO2+O2?2SO3 发生时,能使V(SO2)增大的措施有( )
①增大压强 ②降低压强 ③通入SO2 ④增加的O2量 ⑤升高温度 ⑥降低温度.
①增大压强 ②降低压强 ③通入SO2 ④增加的O2量 ⑤升高温度 ⑥降低温度.
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |