题目内容
14.下列离子方式书写正确的是( )| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2 2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- | |
| D. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
分析 A.依据强酸制弱酸解答;
B.三价铁离子水解生成氢氧化铁胶体和氢离子;
C.二者发生氧化还原反应;
D.二氧化硫具有还原性,能够被次氯酸根离子氧化.
解答 解:A.H2CO3>HClO>HCO3-,则NaClO溶液中通入少量二氧化碳反应生成次氯酸和碳酸氢钠,故A错误;
B.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体,离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故B错误;
C.Na2S溶液中滴加NaClO溶液,离子方程式:S2-+ClO-+H2O=S↓+Cl-+2OH-,故C正确;
D.SO2具有还原性,与ClO-发生氧化还原反应,反应的离子方程式为:ClO-+SO2+H2O═2H++Cl-+SO42-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,侧重于学生的分析能力的考查,注意把握离子的性质以及反应类型的判断,把握离子方程式的书写方法.

练习册系列答案
相关题目
18.下列物质属于电解质的是( )
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
①氢氧化钾 ②硫酸钡 ③铜 ④蔗糖⑤氨气 ⑥稀硫酸 ⑦熔融的KNO3.
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
5.某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图.
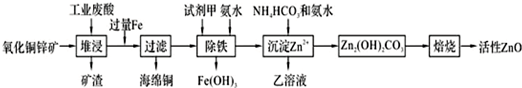
已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”、“<”或“=”).
(2)除铁过程中试剂甲最好选用B(填序号).
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在3.2~6.2范围之间.
(4)试写出沉淀Zn2+时发生反应的离子方程式:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.

已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”、“<”或“=”).
(2)除铁过程中试剂甲最好选用B(填序号).
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在3.2~6.2范围之间.
(4)试写出沉淀Zn2+时发生反应的离子方程式:2Zn2++3NH3?H2O+HCO3-=Zn2(OH)2CO3↓+3NH4++H2O.
9.下列说法正确的是( )
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 乙烷和乙醇均能发生取代反应 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
19.青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺如图所示.
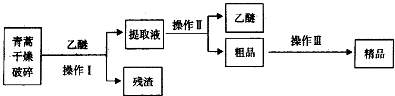
请回答下列问题:
(1)操作Ⅱ的名称是蒸馏.
(2)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
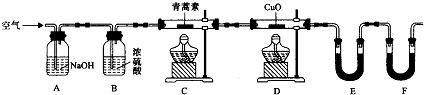
①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.装置D的作用是使生成的CO转化成CO2而被吸收.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
则测得青蒿素的最简式是C15H22O5.
(4)充分燃烧后还需缓缓通入空气数分钟的目的是使生成的CO2和水蒸气全部赶到装置E和装置F中被完全吸收.

请回答下列问题:
(1)操作Ⅱ的名称是蒸馏.
(2)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.

①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.装置D的作用是使生成的CO转化成CO2而被吸收.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)充分燃烧后还需缓缓通入空气数分钟的目的是使生成的CO2和水蒸气全部赶到装置E和装置F中被完全吸收.
6.一定条件下反应:2SO2+O2?2SO3 发生时,能使V(SO2)增大的措施有( )
①增大压强 ②降低压强 ③通入SO2 ④增加的O2量 ⑤升高温度 ⑥降低温度.
①增大压强 ②降低压强 ③通入SO2 ④增加的O2量 ⑤升高温度 ⑥降低温度.
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
 和
和 ;
; 和O=C=O.
和O=C=O.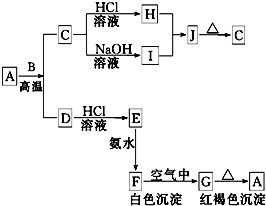 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.