题目内容
20.工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).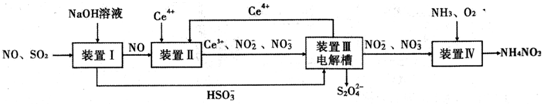
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式NO+H2O+Ce4+=Ce3++NO2-+2H+.
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
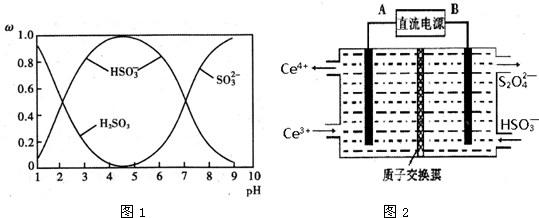
①下列说法正确的是ABC(填标号).
A.pH=7时,溶液中c( Na+)=3c (HSO-3)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中 c(OH-)=c (H+)+c(HSO3-)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O.
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在酸式(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的正(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为4480 L.
分析 装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,
装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-,
(1)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(2)①A.pH=7时,溶液为中性,结合电荷守恒分析;
B.HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- );
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大;
D.根据质子守恒判断;
②NaOH的物质的量为1mol,根据2NaOH+SO2═Na2SO3+H2O可知二氧化硫过量,过量部分的二氧化硫再发生反应Na2SO3+H2O+SO2═2NaHSO3,依据方程式进行计算n(SO32-):n(HSO3-)的比,据此书写离子方程式;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液;酸性高锰酸钾具有强氧化性,能氧化碱式滴定管橡皮管;原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上;反应物是HSO3-被还原成S2O42-,得到电子;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,设消耗标况下氧气的体积是V,结合电子守恒进行计算.
解答 解:装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2++2H++2NH3=2NH4++2NO3-,
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)①A.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故A正确;
B.HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.溶液存在质子守恒,应为c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3),故D错误;
故答案为:ABC;
②1L1.0mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1L×1.0mol/L=1.0mol,13.44L(标况下)SO2,n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,
设反应生成亚硫酸钠的物质的量为x,消耗二氧化硫的物质的量为y
2NaOH+SO2═Na2SO3+H2O
2 1 1
1.0mol y x
$\frac{2}{1.0mol}$=$\frac{1}{y}$=$\frac{1}{x}$解得:x=0.5mol y=0.5mol根据上述计算可以知道,二氧化硫是过量的,剩余的二氧化硫的物质的量为:0.6mol-0.5mol=0.1mol
所以二氧化硫会和生成的亚硫酸钠继续反应,
设消耗亚硫酸钠的物质的量为a,生成亚硫酸氢钠的物质的量为b
Na2SO3+H2O+SO2═2NaHSO3
1 1 2
a 0.1mol b
$\frac{1}{a}$=$\frac{2}{b}$=$\frac{1}{0.3mol}$解得:a=0.1mol b=0.2mol,
则溶液中n(SO32-)=0.5mol-0.1mol=0.4mol,n(HSO3-)=0.2mol,n(SO32-):n(HSO3-)=2:1,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O,
故答案为:3SO2+5OH-=2SO32-+HSO3-+2H2O;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液,酸性高锰酸钾溶液呈酸性,则可以盛放在酸式滴定管中;原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;
故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:正;2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:$\frac{VL}{22.4L/mol}$×4=1000×(5-3)×0.4mol,解得V=4480L,
故答案为:4480.
点评 本题考查电工业生产中化学原理吸收SO2和NO的工艺,为高频考点,侧重分析、计算能力的考查,题目涉及氧化还原反应、离子浓度比较、电化学等,综合性强,题目难度较大.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 标准状况下,22.4L水中含有NA个水分子 | |
| B. | 常温常压下,28gCO中所含的原子数目为2NA | |
| C. | 如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n | |
| D. | 1mo1/L的AlC13溶液中,C1-离子的数目为3NA |
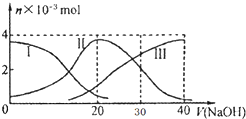 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A=H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)═c(A2-)+2 c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| A. | 1:20 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
| A. | F | B. | Cl | C. | O | D. | Na |
①淀粉 ②福尔马林 ③纤维素 ④蚁酸 ⑤甲酸乙酯 ⑥乙酸甲酯 ⑦甲酸钠 ⑧蔗糖 ⑨白酒 ⑩食醋⑪麦芽糖.
| A. | 全部 | B. | ①③④⑤⑨ | C. | ②④⑤⑦⑪ | D. | ②④⑤⑥⑦⑧ |
Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2.在温度
973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是加入催化剂或增大体系的压强.
②图乙中t2时刻发生改变的条件是降低温度或增加水蒸气的量或减少氢气的量.

 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题. (1)下列分子中,属于平面型构型的有CD.
(1)下列分子中,属于平面型构型的有CD.