题目内容
15. ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.(1)基态B原子核外电子排布式1s22s22p1,在BF3分子中中心原子B的轨道杂化方
式sp2杂化.
(2)氯化铝(AlCl3)为无色透明晶体或白色而微带浅黄色的结晶性粉末,密度2.44g/cm3,熔点190℃(2.5大气压),沸点182.7℃,在177.8℃升华,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚成Al2Cl6形式存在,则氯化铝属于分子晶体(填所属晶体类型)
(3)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,砷化镓晶胞结构与金刚石相似.试回答下列问题:
①下列说法正确的是AD(填序号).
A.砷化镓晶胞结构中Ga原子的轨道杂化方式为sp3
B.第一电离能:As<Ga
C.电负性:As<Ga
D.砷和镓都属于p区元素
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为(CH3)3Ga+AsH3$\stackrel{700℃}{→}$GaAs+3CH4.
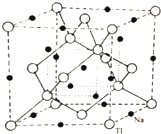
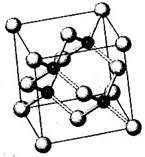
(4)铊化钠的晶胞结构如图,该物质化学式为NaTl.已知该晶体是立方晶系,Na、Tl最近距离为a pm,写出计算该晶体的密度$\frac{681\sqrt{3}}{8×1{0}^{-30}×{N}_{A}×{a}^{3}}$ g/cm3.(已知阿佛加德罗常数:NA•mol-1)
分析 (1)B原子核外电子数为5,根据能量最低原理书写核外电子排布式;BF3分子中B原子形成3个B-F键,没有孤对电子,杂化轨道数目为3;
(2)氯化铝的熔沸点比较低,易溶液非金属性溶解,应属于分子晶体;
(3)①A.砷化镓晶胞结构与金刚石相似,Ga原子周围有4个As原子,杂化轨道数目为4;
B.同周期元素从左到右第一电离能呈增大趋势,ⅡA、ⅤA族高于同周期相邻元素的;
C.同周期元素从左到右电负性逐渐增大;
D.As、Ga分别处于VA族、ⅢA族,处于p区元素;
②砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,根据原子守恒可知还生成CH4;
(4)根据均摊法计算晶胞中Na、Tl原子数目,确定化学式,计算晶胞质量,晶胞体内小立方体体心黑色球与小立方体顶点白色球之间距离最近,则晶胞体对角线长度为4a pm,故晶胞棱长为$\frac{4a}{\sqrt{3}}$ pm,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)B原子核外电子数为5,核外电子排布式为1s22s22p1;BF3分子中B原子形成3个B-F键,没有孤对电子,杂化轨道数目为3,B原子采取sp2杂化,
故答案为:1s22s22p1;sp2杂化;
(2)氯化铝的熔沸点比较低,易溶液非金属性溶解,应属于分子晶体,
故答案为:分子;
(3)①A.砷化镓晶胞结构与金刚石相似,Ga原子周围有4个As原子,杂化轨道数目为4,Ga原子的轨道杂化方式为sp3,故A正确;
B.同周期元素从左到右第一电离能呈增大趋势,ⅡA、ⅤA族高于同周期相邻元素的则第一电离能:As>Ga,故B错误;
C.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故C错误;
D.As、Ga分别处于VA族、ⅢA族,处于p区元素,故D正确,
故选:AD;
②反应物为(CH3)3Ga和AsH3,生成物为GaAs,根据原子守恒可知还应生成CH4,反应的化学方程式为:(CH3)3Ga+AsH3$\stackrel{700℃}{→}$GaAs+3CH4,
故答案为:(CH3)3Ga+AsH3$\stackrel{700℃}{→}$GaAs+3CH4;
(4)根据晶胞结构图可知,在晶胞的每个棱边的中点上各有一个钠离子,体心上也有一个钠离子,在由三个相邻的棱边中点和体心构成的互不相邻的四个正四面体的中心也有一个钠离子,这样将所有钠离子连起来,结构与金刚石的结构相似,根据均摊法,晶胞中含有的T1的原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8、Na的个数为12×$\frac{1}{4}$+1+4=8,所以该晶胞中钠离子和铊离子个数为8:8=1:1,所以其化学式为NaTl;
晶胞质量为8×$\frac{23+204}{{N}_{A}}$g,晶胞体内小立方体体心黑色球与小立方体顶点白色球之间距离最近,则晶胞体对角线长度为4a pm,故晶胞棱长为$\frac{4a}{\sqrt{3}}$ pm,则晶胞密度为:8×$\frac{23+204}{{N}_{A}}$g÷($\frac{4a}{\sqrt{3}}$×10-10 cm)3=$\frac{681\sqrt{3}}{8×1{0}^{-30}×{N}_{A}×{a}^{3}}$g.cm-3,
故答案为:NaTl;$\frac{681\sqrt{3}}{8×1{0}^{-30}×{N}_{A}×{a}^{3}}$.
点评 本题考查是度物质结构与性质的考查,涉及核外电子排布、晶体类型与性质、电离能、电负性、晶胞计算等,(4)中为难点、易错点,需要学生具备一定的空间想象与数学计算能力,关键是确定处于最近位置的Tl、Na原子计算晶胞棱长.

| A. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| B. | 氧化镁用作耐火材料 | |
| C. | 利用NaHCO3治疗胃酸过多 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
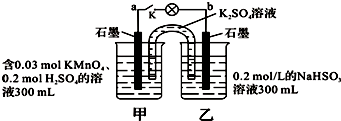
| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1 mol•L-1 | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,外电路的电子方向是从a到b | |
| D. | 乙池中的氧化产物为SO42- |
| A. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| B. | 向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 1.00 mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 纯净矿泉水、铝热剂、漂白粉均为混合物 |
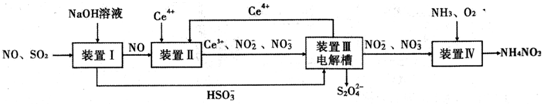
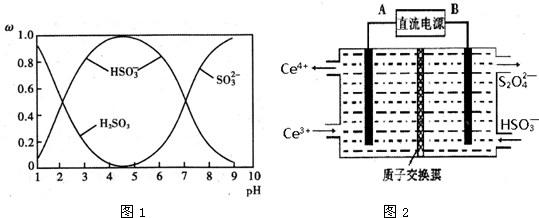
 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题: