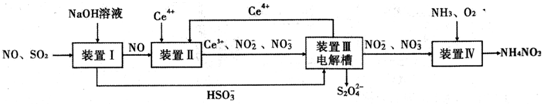
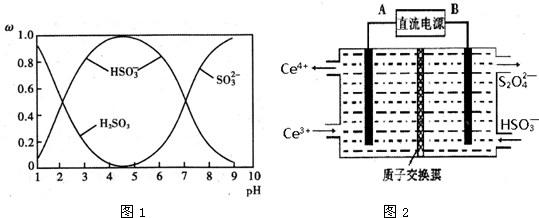
题目内容
8.常温下,将pH为4的硫酸溶液稀释10000倍,稀释后溶液中c(SO42-):c(H+)约是( )| A. | 1:20 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
分析 依据pH=-lg[H+],计算pH=4的硫酸溶液中,氢离子的物质的量浓度,依据H2SO4=2H++SO42-,计算硫酸根离子的浓度;稀释10000倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度,据此计算解答.
解答 解:由pH=-lg[H+]可知pH=4的硫酸溶液中c(H+)=1×10-4mol/L,硫酸为强电解质完全电离,氢离子浓度为硫酸根离子浓度2倍,所以c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-4mol/L=5×10-5mol/L;
溶液稀释10000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L;
硫酸根离子浓度为:c(SO42-)=5×10-5mol/L×$\frac{1}{10000}$=5×10-9mol/L,
稀释后溶液中SO42-离子浓度与H+离子浓度与比值约为:5×10-9mol/L:1×10-7mol/L=1:20,
故选A.
点评 本题考查了有关pH值计算以及溶液的稀释,注意掌握溶液酸碱性与溶液pH的关系,溶液稀释过程中pH值变化的规律是解题关键,注意酸碱稀释接近中性应考虑水的电离.

练习册系列答案
相关题目
19.下列离子的检验方法合理的是( )
| A. | 向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ | |
| B. | 向某溶液中加入酸性KMnO4溶液,溶液褪色,说明原溶液中一定含Fe2+ | |
| C. | 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中含有Fe2+,可能含有Mg2+ |
16.用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示.下列有关说法错误的是
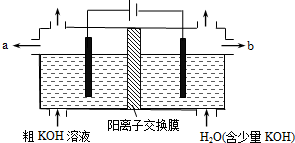 ( )
( )
 ( )
( )| A. | 阳极反应式为4OH--4e-=2H2O+O2↑ | B. | 通电后阴极区附近溶液pH会增大 | ||
| C. | K+通过交换膜从阴极区移向阳极区 | D. | 纯净的KOH溶液从b出口导出 |
3.如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
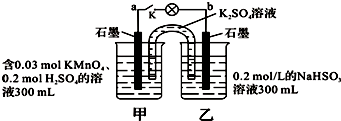

| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1 mol•L-1 | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,外电路的电子方向是从a到b | |
| D. | 乙池中的氧化产物为SO42- |
13.该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4•7H2O过程如下:
a.在混合液中加入6mol•L-1NaOH溶液,至pH=8为止.
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀.
c.向洗涤后的沉淀中加入2mol•L-1的硫酸,保持溶液的pH在4-6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液.
d.滤液中加入2mol•L-1的硫酸,使其pH=2.
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
(1)步骤b中如何检验沉淀已经洗涤干净取最后一次洗涤液少量,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净.
(2)步骤d中加入硫酸,使其pH=2的目的是抑制Zn2+的水解; 要制得ZnSO4•7H2O的步骤d还缺少的操作是将溶液加热浓缩、冷却结晶,
所用的主要硅酸盐仪器是蒸发皿、酒精灯、玻璃棒.
a.在混合液中加入6mol•L-1NaOH溶液,至pH=8为止.
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀.
c.向洗涤后的沉淀中加入2mol•L-1的硫酸,保持溶液的pH在4-6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液.
d.滤液中加入2mol•L-1的硫酸,使其pH=2.
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5-3.2 | 6.4-8.0 |
(2)步骤d中加入硫酸,使其pH=2的目的是抑制Zn2+的水解; 要制得ZnSO4•7H2O的步骤d还缺少的操作是将溶液加热浓缩、冷却结晶,
所用的主要硅酸盐仪器是蒸发皿、酒精灯、玻璃棒.
17.a、b、c、d四种元素在周期表中的位置如图,则下列说法正确的是( )


| A. | 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3 | |
| B. | 若b的单质可作半导体材料,则c的单质不可能为半导体材料 | |
| C. | 若b的单质与H2易化合,则c的单质与H2更易化合 | |
| D. | a与b之间容易形成离子化合物 |