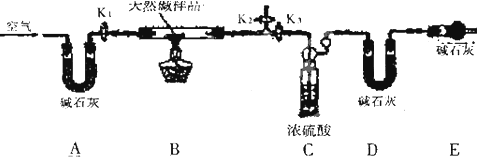
题目内容
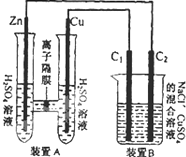 有如图装置,回答下列问题:
有如图装置,回答下列问题:(1)装置B是
(2)装置A中的Zn极是
(3)锌与铁组成的合金在潮湿的空气中,发生腐蚀,其正极反应式为
(4)装置B中两极为石墨棒C1,C2.池中是浓度均为 0.2mol?L-1的NaCl、CuSO4混合溶液,溶液体积为 500mL.当装置A中Zn棒质量减少32.5g时,C2上质量增加
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)A装置能自发的进行氧化还原反应,所以构成原电池,则B为电解池;
(2)Zn易失电子作负极、Cu作正极,Cu电极上氢离子放电;
(3)Fe、Zn和潮湿的空气构成原电池,发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(4)装置B中两极为石墨棒C1、C2分别是阳极、阴极,B中n(NaCl)=n(CuSO4)=0.2mol/L×0.5L=0.1mol,根据转移电子相等计算.
(2)Zn易失电子作负极、Cu作正极,Cu电极上氢离子放电;
(3)Fe、Zn和潮湿的空气构成原电池,发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(4)装置B中两极为石墨棒C1、C2分别是阳极、阴极,B中n(NaCl)=n(CuSO4)=0.2mol/L×0.5L=0.1mol,根据转移电子相等计算.
解答:
解:(1)A装置能自发的进行氧化还原反应,所以构成原电池,B有外接电源,则B为电解池,故答案为:电解;
(2)Zn易失电子作负极、Cu作正极,Cu电极上氢离子放电,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(3)Fe、Zn和潮湿的空气构成原电池,发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)装置B中两极为石墨棒C1、C2分别是阳极、阴极,B中n(NaCl)=n(CuSO4)=0.2mol/L×0.5L=0.1mol,锌棒消耗32.5g时,转移电子的物质的量=
×2=1mol,如果铜离子完全析出,转移电子的物质的量=0.1mol×2=0.2mol<1mol,阴极上含有氢气生成,铜完全析出,则C2上增加质量=0.1mol×64g/mol=6.4g,
故答案为:6.4.
(2)Zn易失电子作负极、Cu作正极,Cu电极上氢离子放电,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(3)Fe、Zn和潮湿的空气构成原电池,发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)装置B中两极为石墨棒C1、C2分别是阳极、阴极,B中n(NaCl)=n(CuSO4)=0.2mol/L×0.5L=0.1mol,锌棒消耗32.5g时,转移电子的物质的量=
| 32.5g |
| 65g/mol |
故答案为:6.4.
点评:本题考查了原电池和电解池原理,知道原电池和电解池的判断方法、各个电极上发生的反应即可解答,注意(4)中不能单纯的根据转移电子相等计算C2上析出金属质量,还要进行过量计算,为易错点.

练习册系列答案
相关题目
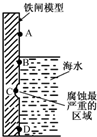 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.