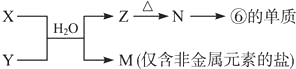
题目内容
水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有 、 ;
(2)天然水在净化处理过程中加入的混凝剂可以是 (填一种物质的名称即可),其净水作用的原理是 (书写离子方程式并加以说明);
(3)请你用一种简单的实验方法区别软水和硬水: ;
(4)下列有关说法中正确的是 (选填编号)
①除去水中的永久硬度只能用药剂软化法;
②经过磺化煤(NaR)处理过的水是不含杂质离子的纯净水;
③烧水时形成水垢是由水的暂时硬度引起的;
④加入混凝剂不但能除去水中的悬浮物和胶体杂质,还能杀菌消毒;
⑤电解饱和食盐水,阴极区可得到氢氧化钠溶液,同时析出氢气.
(5)硬度为1°的水是指每升水含10mg CaO或者7.1mg MgO).若某天然水中[Ca2+]=1.2×10-3 mol?L-1,[Mg2+]=6×10-4 mol?L-1,则此水的总硬度为 (保留1位小数).
(1)天然水中溶解的气体主要有
(2)天然水在净化处理过程中加入的混凝剂可以是
(3)请你用一种简单的实验方法区别软水和硬水:
(4)下列有关说法中正确的是
①除去水中的永久硬度只能用药剂软化法;
②经过磺化煤(NaR)处理过的水是不含杂质离子的纯净水;
③烧水时形成水垢是由水的暂时硬度引起的;
④加入混凝剂不但能除去水中的悬浮物和胶体杂质,还能杀菌消毒;
⑤电解饱和食盐水,阴极区可得到氢氧化钠溶液,同时析出氢气.
(5)硬度为1°的水是指每升水含10mg CaO或者7.1mg MgO).若某天然水中[Ca2+]=1.2×10-3 mol?L-1,[Mg2+]=6×10-4 mol?L-1,则此水的总硬度为
考点:物质的分离、提纯的基本方法选择与应用,物质的检验和鉴别的基本方法选择及应用
专题:实验设计题
分析:(1)天然水中溶解的气体氧气、氮气和二氧化碳等;
(2)常用明矾、硫酸铝或硫酸铁作为混凝剂,因都可水解生成具有吸附性的胶体;
(3)硬水含有的钙、镁离子浓度较大,加入肥皂水不生成泡沫;
(4)①除去水中的永久硬度可用药剂软化法、离子交换法等;
②经过磺化煤(NaR)处理过的水不是纯净水;
③烧水时形成水垢是由水的暂时硬度引起的,形成碳酸钙、氢氧化镁等;
④加入混凝剂不能杀菌消毒;
⑤电解饱和食盐水,阴极区发生还原反应,可得到氢氧化钠溶液,同时析出氢气.
(5)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到.
(2)常用明矾、硫酸铝或硫酸铁作为混凝剂,因都可水解生成具有吸附性的胶体;
(3)硬水含有的钙、镁离子浓度较大,加入肥皂水不生成泡沫;
(4)①除去水中的永久硬度可用药剂软化法、离子交换法等;
②经过磺化煤(NaR)处理过的水不是纯净水;
③烧水时形成水垢是由水的暂时硬度引起的,形成碳酸钙、氢氧化镁等;
④加入混凝剂不能杀菌消毒;
⑤电解饱和食盐水,阴极区发生还原反应,可得到氢氧化钠溶液,同时析出氢气.
(5)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到.
解答:
解:(1)天然水中溶解的气体氧气、氮气和二氧化碳等,故答案为:O2;CO2或N2;
(2)常用明矾、硫酸铝或硫酸铁作为混凝剂,因都可水解生成具有吸附性的胶体,如明矾中铝离子和水解:Al3++3H2O?Al (OH)3(胶体)+3H+,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物和胶体杂质,故能净水,
故答案为:明矾、硫酸铝或硫酸铁等;Al3++3H2O?Al (OH)3(胶体)+3H+,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物和胶体杂质,故能净水;
(3)硬水含有的钙、镁离子浓度较大,加入肥皂水不生成泡沫,可在水中加入肥皂水,泡沫较多的为软水,泡沫较少或产生白色浑浊的为硬水,
故答案为:在水中加入肥皂水,泡沫较多的为软水,泡沫较少或产生白色浑浊的为硬水;
(4)①除去水中的永久硬度可用药剂软化法、离子交换法等,故错误;
②经过磺化煤(NaR)处理过的水不是纯净水,含有钠离子等,故错误;
③烧水时形成水垢是由水的暂时硬度引起的,形成碳酸钙、氢氧化镁等,故正确;
④加入混凝剂不能杀菌消毒,能除去水中的悬浮物和胶体杂质,故错误;
⑤电解饱和食盐水,阴极区发生还原反应,可得到氢氧化钠溶液,同时析出氢气,故正确.
故答案为:③⑤;
(5)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol?L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=
+
=10.1°故答案为:10.1.
(2)常用明矾、硫酸铝或硫酸铁作为混凝剂,因都可水解生成具有吸附性的胶体,如明矾中铝离子和水解:Al3++3H2O?Al (OH)3(胶体)+3H+,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物和胶体杂质,故能净水,
故答案为:明矾、硫酸铝或硫酸铁等;Al3++3H2O?Al (OH)3(胶体)+3H+,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物和胶体杂质,故能净水;
(3)硬水含有的钙、镁离子浓度较大,加入肥皂水不生成泡沫,可在水中加入肥皂水,泡沫较多的为软水,泡沫较少或产生白色浑浊的为硬水,
故答案为:在水中加入肥皂水,泡沫较多的为软水,泡沫较少或产生白色浑浊的为硬水;
(4)①除去水中的永久硬度可用药剂软化法、离子交换法等,故错误;
②经过磺化煤(NaR)处理过的水不是纯净水,含有钠离子等,故错误;
③烧水时形成水垢是由水的暂时硬度引起的,形成碳酸钙、氢氧化镁等,故正确;
④加入混凝剂不能杀菌消毒,能除去水中的悬浮物和胶体杂质,故错误;
⑤电解饱和食盐水,阴极区发生还原反应,可得到氢氧化钠溶液,同时析出氢气,故正确.
故答案为:③⑤;
(5)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol?L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=
| 76.2mg |
| 10mg |
| 24mg |
| 7.1mg |
点评:本题考查较为综合,涉及物质的分离、提纯以及检验,综合考查学生的分析能力和实验能力,注意把握盐类水解的应用,净水方法和软化原理,水的硬度计算需要理解题干信息,准确计算,题目难度中等.

练习册系列答案
相关题目
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,下列说法正确的是( )
| A、N4属于一种新型的化合物 |
| B、N4与N2的摩尔质量相等 |
| C、等质量的N4与N2所含的原子个数比为1:1 |
| D、等质量的N4与N2所含的原子个数比为2:1 |
可逆反应A(g)+3B(g)?2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是( )
| A、v(A)=0.15mol/(L?min) |
| B、v (B)=0.6 mol/(L?min) |
| C、v (C)=0.3 mol/(L?min) |
| D、v (D)=0.1 mol/(L?min) |
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
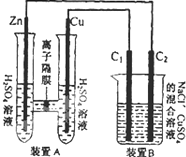 有如图装置,回答下列问题:
有如图装置,回答下列问题: