题目内容
某天然碱化学组成可能为aNa2C03?bNaHC03?cH2O(a、b、c为正整数),为确定其组成,某同学作了如下探究:
(1)定性分析
取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝.能否说明样品中含结晶水,试简述理由. .
(2)定量分析
该同学设计了如图所示装置,测定天然碱的化学组成.
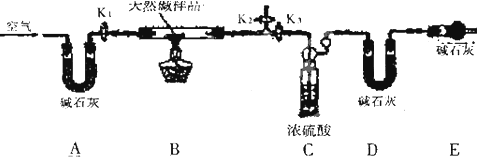
实验步骤:
①按如图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 ;A处碱石灰的作用是: .
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U形管D的质量为74.7g.
③打开活塞K1、K2,关闭K3,缓缓鼓人空气数分钟.
④关闭活塞Kl、K2,打开K3,点燃酒精灯加热,待不再产生气体为止.
⑤打开活塞Kl,缓缓鼓人空气数分钟,然后称得装浓硫酸的洗气瓶的质量为88.5g;装碱石灰的U形管D的质量为75.8g.该步骤中缓缓鼓入空气的目的是 .计算推导:该天然碱的化学式为 .
(3)讨论:有的同学认为:E装置是可以省略的,你的观点是 (“能”或“不能”)
理由是: .
(1)定性分析
取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝.能否说明样品中含结晶水,试简述理由.
(2)定量分析
该同学设计了如图所示装置,测定天然碱的化学组成.

实验步骤:
①按如图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U形管D的质量为74.7g.
③打开活塞K1、K2,关闭K3,缓缓鼓人空气数分钟.
④关闭活塞Kl、K2,打开K3,点燃酒精灯加热,待不再产生气体为止.
⑤打开活塞Kl,缓缓鼓人空气数分钟,然后称得装浓硫酸的洗气瓶的质量为88.5g;装碱石灰的U形管D的质量为75.8g.该步骤中缓缓鼓入空气的目的是
(3)讨论:有的同学认为:E装置是可以省略的,你的观点是
理由是:
考点:探究碳酸钠与碳酸氢钠的性质
专题:实验设计题
分析:(1)碳酸氢钠分解会生成水,所以取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝,不能说明样品中含有结晶水;
(2)①装载气密性会影响测定结果,所以实验前必须检查装置的气密性;
⑤根据碱石灰的质量变化计算出二氧化碳的质量,从而计算出碳酸氢钠的物质的量及碳酸氢钠分解生成的水的物质的量,再根据浓硫酸的质量变化及碳酸氢钠分解生成水的质量计算出结晶水质量,最后计算出样品中碳酸钠的质量,从而得出该样品的化学式;
(3)没有装置E,空气中的二氧化碳和水会进入装置D,影响测定结果.
(2)①装载气密性会影响测定结果,所以实验前必须检查装置的气密性;
⑤根据碱石灰的质量变化计算出二氧化碳的质量,从而计算出碳酸氢钠的物质的量及碳酸氢钠分解生成的水的物质的量,再根据浓硫酸的质量变化及碳酸氢钠分解生成水的质量计算出结晶水质量,最后计算出样品中碳酸钠的质量,从而得出该样品的化学式;
(3)没有装置E,空气中的二氧化碳和水会进入装置D,影响测定结果.
解答:
解:(1)由于反应2NaHCO3
Na2CO3+CO2↑+H2O中有水生成,所以不能说明样品中含结晶水,
故答案为:不能,因为NaHCO3受热分解也能产生水蒸气;
(2)①该实验中使用了多个实验装置,在实验前必须检查装置的气密性,避免影响测定结果;装置A中的碱石灰作用是除去空气中的CO2和H2O(g),
故答案为:检查装置的气密性;除去空气中的CO2和H2O(g);
⑤该步骤中缓缓鼓入空气的目的是将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收,减小测定误差,
由题意可知:装碱石灰的U形管D的增重的物质是CO2,二氧化碳的质量为:75.8 g-74.7=1.1 g,n(CO2)=
=0.025 mol,
则2NaHCO3
Na2CO3 +CO2↑+H2O
2 1 1 1
0.05mol 0.025mol 0.025mol 0.025mol
m(NaHCO3)=0.05 mol×84 g?mol-1=4.2 g
浓硫酸吸收的水为碳酸氢钠分解生成的和样品中的结晶水,水的质量之和为:88.5g-87.6g=0.9g,
所以晶体中含有的结晶水的物质的量为:n(H2O)=
-0.025mol=0.025mol,
样品中含有的结晶水的质量为:m(H2O)=0.025 mol×18 g?mol-1=0.45g,
样品中含有的水的质量为:m(Na2CO3)=7.3g-4.2g-0.45g=2.65g,n(Na2CO3)=
=0.025mol,
故晶体中n(Na2CO3):n(NaHCO3):n(H2O)=0.025 mol:0.05 mol:0.025 mol=1:2:1,
所以晶体化学式为:Na2CO3?2NaHCO3?H2O,
故答案为:将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收;Na2CO3?2NaHCO3?H2O;
(3)本实验是通过测定生成二氧化碳和水的物质的量计算出样品的组成,如果没有装载D,空气的中CO2和H2O(g)进入D装置,导致测量结果不准确,
故答案为:不能;防止空气中CO2和H2O(g)进入D装置,导致测量不准确.
| ||
故答案为:不能,因为NaHCO3受热分解也能产生水蒸气;
(2)①该实验中使用了多个实验装置,在实验前必须检查装置的气密性,避免影响测定结果;装置A中的碱石灰作用是除去空气中的CO2和H2O(g),
故答案为:检查装置的气密性;除去空气中的CO2和H2O(g);
⑤该步骤中缓缓鼓入空气的目的是将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收,减小测定误差,
由题意可知:装碱石灰的U形管D的增重的物质是CO2,二氧化碳的质量为:75.8 g-74.7=1.1 g,n(CO2)=
| 1.1g |
| 44g/mol |
则2NaHCO3
| ||
2 1 1 1
0.05mol 0.025mol 0.025mol 0.025mol
m(NaHCO3)=0.05 mol×84 g?mol-1=4.2 g
浓硫酸吸收的水为碳酸氢钠分解生成的和样品中的结晶水,水的质量之和为:88.5g-87.6g=0.9g,
所以晶体中含有的结晶水的物质的量为:n(H2O)=
| 0.9g |
| 18g/mol |
样品中含有的结晶水的质量为:m(H2O)=0.025 mol×18 g?mol-1=0.45g,
样品中含有的水的质量为:m(Na2CO3)=7.3g-4.2g-0.45g=2.65g,n(Na2CO3)=
| 2.65g |
| 106g/mol |
故晶体中n(Na2CO3):n(NaHCO3):n(H2O)=0.025 mol:0.05 mol:0.025 mol=1:2:1,
所以晶体化学式为:Na2CO3?2NaHCO3?H2O,
故答案为:将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收;Na2CO3?2NaHCO3?H2O;
(3)本实验是通过测定生成二氧化碳和水的物质的量计算出样品的组成,如果没有装载D,空气的中CO2和H2O(g)进入D装置,导致测量结果不准确,
故答案为:不能;防止空气中CO2和H2O(g)进入D装置,导致测量不准确.
点评:本题考查Na2CO3和NaHCO3有关性质、化学计算等知识,试题综合性较强,题目难度稍大,注意掌握碳酸钠、碳酸氢钠的性质,明确化学计算的方法与技巧,试题培养了学生的分析、理解能力.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列实验操作与安全事故处理正确的是( )
| A、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 | ||
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 | ||
C、用试管夹从试管底由下往上夹住距离管口约
| ||
| D、把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,46g NO2中含有的分子数为NA |
| B、通常状况下,14g CO含有的电子数目为7NA |
| C、1L 0.2 mol/L的CH3COOH溶液中,H+数目为0.2NA |
| D、0.1mol Cu 和与40mL 10mol/L硝酸反应后,溶液中的NO3-数目为0.2NA |
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
 有如图装置,回答下列问题:
有如图装置,回答下列问题: