题目内容
6.下列有关实验操作、现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HNO3无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向溶液中加入少量KSCN溶液 | 有血红色溶液生成 | 溶液中含有Fe2+ |
| D | 向硫酸铜溶液中持续滴加氨水溶液 | 先有蓝色沉淀生成后溶解 | 氢氧化铜发生反应生成了[Cu(NH3)4]2+离子 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硝酸能氧化SO32-生成SO42-;
B.如果浓度商大于溶度积,则产生沉淀;
C.Fe2+和KSCN不反应,Fe3+和KSCN反应产生血红色;
D.铜离子和氨水反应先生成氢氧化铜沉淀,当氨水过量时,一水合氨和氢氧化铜反应生成铜铵络合物.
解答 解:A.硝酸能氧化SO32-生成SO42-,所以不能用硝酸酸化溶液,应该用稀盐酸,所以该实验现象不能证明溶液中是否含有硫酸根离子,故A错误;
B.如果浓度商大于溶度积,则产生沉淀,加入KCl后,溶液中c(Ag+).c(Cl-)>Ksp,则产生AgCl白色沉淀,该实验不能证明AgCl比AgI更难溶,故B错误;
C.Fe2+和KSCN不反应,Fe3+和KSCN反应产生血红色,应该用高锰酸钾溶液检验亚铁离子,故C错误;
D.铜离子和氨水反应先生成氢氧化铜沉淀,当氨水过量时,一水合氨和氢氧化铜反应生成铜铵络合物,所以向硫酸铜溶液中持续滴加氨水溶液,先生成蓝色沉淀后沉淀溶解,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、沉淀转化、络合物等知识点,明确实验原理、物质性质是解本题关键,注意:离子检验时要排除其它离子干扰,易错选项是A.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
2.合成导电高分子化合物PPV的反应为:
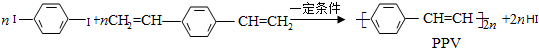
下列说法正确的是( )
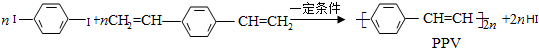
下列说法正确的是( )
| A. | PPV是聚苯乙炔 | |
| B. | 该反应为缩聚反应 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol 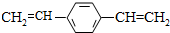 最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
17.下列物质不能导电但属于电解质的是( )
| A. | 熔融的氯化镁 | B. | 饱和食盐水 | C. | 固态二氧化碳 | D. | 液态氯化氢 |
14.下列表示电子式的形成过程正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
11.“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型一定符合这一要求的是( )
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
18.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
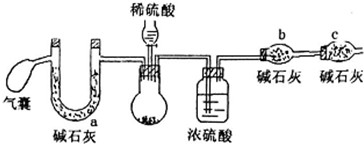
16.过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下实验方案:
方案一:取m1g样品,加入足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g
方案二:取m1g样品,用如下装置测得生成二氧化碳的质量m3g
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用c mol•L-1的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为V mL
回答下列问题:(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大.
(2)方案二中,气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收.
C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”、“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应后的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加2滴酚酞试液,观察到溶液变红后褪色的时间如下:
此实验得出的结论是:酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快.
设计实验验证假设二:取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.

方案一:取m1g样品,加入足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g
方案二:取m1g样品,用如下装置测得生成二氧化碳的质量m3g
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用c mol•L-1的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为V mL
回答下列问题:(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大.
(2)方案二中,气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收.
C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”、“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应后的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加2滴酚酞试液,观察到溶液变红后褪色的时间如下:
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 溶液变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
设计实验验证假设二:取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
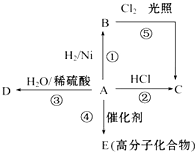 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: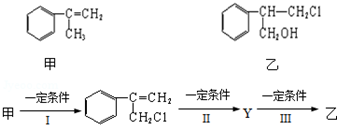
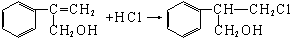 .
.