题目内容
14.下列表示电子式的形成过程正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.HCl为共价化合物,原子间以共用电子对成键;
B.MgF2属于离子化合物,Mg最外层两个电子被两个F原子得到;
C.NaBr为离子化合物,由离子构成;
D.CaS为离子化合物,由离子构成.
解答 解:A.HCl为共价化合物,原子间以共用电子对成键,用电子式表示形成过程为 ,故A错误;
,故A错误;
B.MgF2属于离子化合物,Mg最外层两个电子被两个F原子得到,用电子式表示形成过程为 ,故B错误;
,故B错误;
C.NaBr属于离子化合物,Na原子最外层电子被Br原子得到,用电子式表示形成过程为: ,故C错误;
,故C错误;
D.CaS为离子化合物,Ca失去电子被S得到,用电子式表示形成过程为: ,故D正确.
,故D正确.
故选D.
点评 本题考查了离子键、共价键的判断及用电子式书写化合物的性质过程,明确化合物中存在的化学键是解本题关键,难点是用电子式表示化合物的形成过程,注意把握书写方法.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
10.下列物质的除杂方案正确的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Cl2 (g) | HCl(g) | 饱和NaCl溶液、浓硫酸 | 洗气 |
| B | Na2CO3(aq) | NaHCO3(aq) | 过量NaOH溶液 | 洗液 |
| C | 铁粉(s) | 铝粉(s) | 过量NaOH溶液 | 过滤 |
| D | FeCl3(aq) | AlCl3(aq) | 过量氨水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.如图所示的有机物G,下列有关说法不正确的是( )
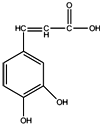

| A. | 1mol该有机物分别与足量的Na、NaOH、Na2CO3反应,消耗它们的物质的量之比为3:3:1 | |
| B. | 所有碳原子可能共平面 | |
| C. | 与溴水既能发生取代反应又能发生加成反应 | |
| D. | 能与新制的Cu(OH)2反应 |
9.在电解质溶液中插入M、N电极,并连接直流电源进行电解,可以看到两极上均有气泡产生,电解后测定电解质溶液,其H+浓度无变化.符合这些条件的是( )
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的Ba(NO3)2溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的HCl溶液 |
6.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HNO3无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向溶液中加入少量KSCN溶液 | 有血红色溶液生成 | 溶液中含有Fe2+ |
| D | 向硫酸铜溶液中持续滴加氨水溶液 | 先有蓝色沉淀生成后溶解 | 氢氧化铜发生反应生成了[Cu(NH3)4]2+离子 |
| A. | A | B. | B | C. | C | D. | D |
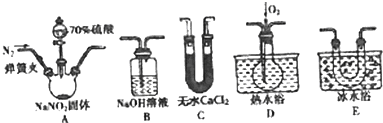

 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):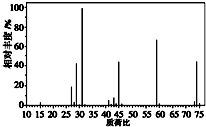 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成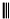 +
+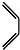 $\stackrel{△}{→}$
$\stackrel{△}{→}$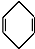 如果要合成
如果要合成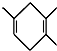 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.