题目内容
11.“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型一定符合这一要求的是( )| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
分析 根据题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知化合反应、加成反应、加聚反应达到绿色化学的要求.
解答 解:加成反应只生成一种物质,反应物中的所有原子都转化到生成物中,原子利用率达到100%,符合要求,而取代反应、酯化反应均有副产物,氧化还反应也可能产生其他物质,原子利用率达不到100%,不符合“绿色化学”要求,
故选:B.
点评 本题主要考查了绿色化学的要求,也就是化合反应、加成反应、加聚反应才满足绿色化学的要求,在平时的学习中要加以理解.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
1.下列说法错误的是( )
| A. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
| B. | N原子的轨道表示式: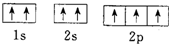 违反了泡利不相容原理 违反了泡利不相容原理 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(23V)1s22s22p63s23p63d34s2违反了洪特规则 |
2.如图所示的有机物G,下列有关说法不正确的是( )
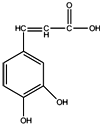

| A. | 1mol该有机物分别与足量的Na、NaOH、Na2CO3反应,消耗它们的物质的量之比为3:3:1 | |
| B. | 所有碳原子可能共平面 | |
| C. | 与溴水既能发生取代反应又能发生加成反应 | |
| D. | 能与新制的Cu(OH)2反应 |
6.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HNO3无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向溶液中加入少量KSCN溶液 | 有血红色溶液生成 | 溶液中含有Fe2+ |
| D | 向硫酸铜溶液中持续滴加氨水溶液 | 先有蓝色沉淀生成后溶解 | 氢氧化铜发生反应生成了[Cu(NH3)4]2+离子 |
| A. | A | B. | B | C. | C | D. | D |
16.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断正确的是( )
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
1.我国西部地区有丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一.
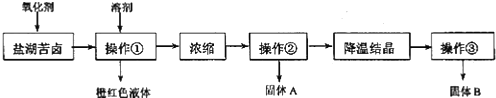
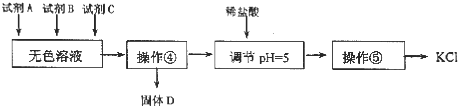
I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
II.某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先 加试剂 A,再加试剂 B,最后加试剂 C(常见的盐),其方案如下:
下列说法不正确的是( )

I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:

II.某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先 加试剂 A,再加试剂 B,最后加试剂 C(常见的盐),其方案如下:

下列说法不正确的是( )
| A. | 要从橙红色液体中分离出单质溴,可采取的操作是蒸馏 | |
| B. | 操作②为过滤,主要目的是为了除去 MgSO4 | |
| C. | 试剂 C为K2CO3,固体D主要为Mg(OH)2、BaSO4,还有少量的BaCO3 | |
| D. | 若在操作④结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤 |

 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):