题目内容
16.过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下实验方案: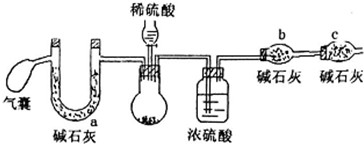
方案一:取m1g样品,加入足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g
方案二:取m1g样品,用如下装置测得生成二氧化碳的质量m3g
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用c mol•L-1的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为V mL
回答下列问题:(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大.
(2)方案二中,气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收.
C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”、“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应后的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加2滴酚酞试液,观察到溶液变红后褪色的时间如下:
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 溶液变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
设计实验验证假设二:取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
分析 (1)反应中会生成微弱的氢氧化钙,导致测定碳酸钙测定质量偏大;
(2)圆底烧瓶中生成二氧化碳,用浓硫酸干燥二氧化硫,干燥管b中碱石灰吸收二氧化碳,根据干燥管b质量增大可知二氧化碳的质量,进而计算样品中碳酸钠的质量,可得过氧化钠的纯度,干燥管c吸收空气中水蒸气与二氧化碳,防止加入b中,开始利用气囊鼓入空气排尽装置中空气,用a装置吸收鼓入空气中二氧化碳与水蒸气,结束后再排出装置中二氧化碳进入b中被完全吸收;
若利用与水代替稀硫酸,挥发出的HCl会被b中碱石灰吸收,测定二氧化碳的质量偏大;
(3)滴定终点落在指示剂的变色范围之内,终点时溶液用颜色由黄色变为橙红色;计算消耗HCl的物质的量,反应生成NaCl,根据离子守恒可知过氧化钠、碳酸钠中钠离子总物质的量,再结合质量列方程计算;
(4)由表中数据可知,酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快;
若由于生成过氧化氢使溶液红色褪去,可以加入二氧化锰使之分解,再加入酚酞溶液,与直接加入酚酞溶液进行对比验证.
解答 解:(1)反应中会生成微弱的氢氧化钙,导致测定碳酸钙测定质量偏大,计算得到碳酸钠的质量偏大,故测得的过氧化钠的纯度比实际的偏低,
故答案为:生成微溶的Ca(OH)2,致使m2数值偏大;
(2)圆底烧瓶中生成二氧化碳,用浓硫酸干燥二氧化硫,干燥管b中碱石灰吸收二氧化碳,根据干燥管b质量增大可知二氧化碳的质量,进而计算样品中碳酸钠的质量,可得过氧化钠的纯度,干燥管c吸收空气中水蒸气与二氧化碳,防止加入b中,开始利用气囊鼓入空气排尽装置中空气,用a装置吸收鼓入空气中二氧化碳与水蒸气,结束后再排出装置中二氧化碳进入b中被完全吸收;
若利用与水代替稀硫酸,挥发出的HCl会被b中碱石灰吸收,测定二氧化碳的质量偏大,计算碳酸钠的质量偏大,故沉淀过氧化钠的纯度偏低,
故答案为:排出装置中生成的CO2完全被碱石灰吸收;防止空气中水和二氧化碳进入b中;低;
(3)滴定终点落在指示剂的变色范围之内,终点时溶液由黄色变成橙色,且半分钟内不变黄,
消耗HCl的物质的量为0.001V L×c mol/L=0.001Vc mol,则生成NaCl为0.001Vc mol,
设过氧化钠、碳酸钠物质的量分别为xmol、ymol,则:
由钠离子守恒:2x+2y=0.001Vc
根据二者总质量:78x+106y=m1
解得x=$\frac{0.053Vc-{m}_{1}}{28}$,
则过氧化钠的含量为$\frac{\frac{0.053Vc-{m}_{1}}{28}mol×78g/mol}{{m}_{1}}$×100%=$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%,
故答案为:溶液由黄色变成橙色,且半分钟内不变黄;$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%;
(4)由表中数据可知,酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快;
若由于生成过氧化氢使溶液红色褪去,可以加入二氧化锰使之分解,再加入酚酞溶液,与直接加入酚酞溶液进行对比验证,验证假设二的实验方案为:取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立,
故答案为:酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快;取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
点评 本题考查物质含量测定实验、物质性质探究实验及实验方案设计等,(3)中含量表达式为易错点,较好地考查学生对原理的理解与分析计算能力,题目难度中等.

| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HNO3无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向溶液中加入少量KSCN溶液 | 有血红色溶液生成 | 溶液中含有Fe2+ |
| D | 向硫酸铜溶液中持续滴加氨水溶液 | 先有蓝色沉淀生成后溶解 | 氢氧化铜发生反应生成了[Cu(NH3)4]2+离子 |
| A. | A | B. | B | C. | C | D. | D |
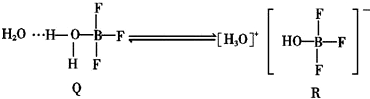
反应过程中新形成的化学键中无( )
| A. | 离子键 | B. | 配位键 | C. | 非极性共价键 | D. | 氢键 |
①混合气体的平均相对分子质量; ②混合气体的密度; ③B的物质的量浓度;
④气体总物质的量; ⑤混合气体的压强 ⑥C、D反应速率的比值.
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
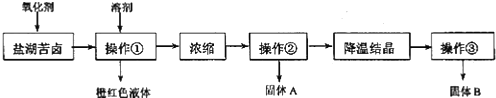
II.某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先 加试剂 A,再加试剂 B,最后加试剂 C(常见的盐),其方案如下:
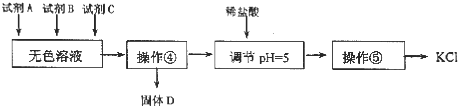
下列说法不正确的是( )
| A. | 要从橙红色液体中分离出单质溴,可采取的操作是蒸馏 | |
| B. | 操作②为过滤,主要目的是为了除去 MgSO4 | |
| C. | 试剂 C为K2CO3,固体D主要为Mg(OH)2、BaSO4,还有少量的BaCO3 | |
| D. | 若在操作④结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤 |
 的准确命名是( )
的准确命名是( )| A. | 3,3二甲基-4-乙基戊烷 | B. | 3,3,4-三甲基已烷 | ||
| C. | 3,3,4,-三甲基已烷 | D. | 2,3,3-三甲基已烷 |
 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$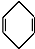 如果要合成
如果要合成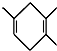 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
 ;
; 3,5,5-三甲基辛烷
3,5,5-三甲基辛烷 3,4,4-三甲基-1-戊炔
3,4,4-三甲基-1-戊炔 1,3-二氯戊烷
1,3-二氯戊烷 1-甲基-4-乙基苯
1-甲基-4-乙基苯