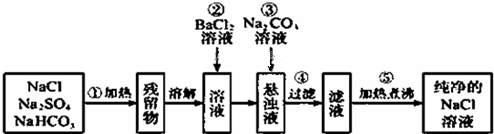
题目内容
近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和不锈钢为电极,以KI溶液(加少量K2CrO4)为电解液在一定条件下电解,反应方程式为KI+3H2O
KIO3+3H2↑.下列有关说法正确的是( )
| 电解 |
| A、电解时,石墨作阴极,不锈钢作阳极 |
| B、电解液调节至强酸性比较合适 |
| C、电解过程中,I-向阴极移动氧化成IO3- |
| D、电解中每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体 |
考点:电解原理
专题:电化学专题
分析:A.根据电池反应式知,阳极上碘离子放电,则阳极为惰性电极;
B.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产;
C.电解时,阴极上氢离子放电,阳极上碘离子放电;
D.根据电解方程式结合碘酸钾和转移电子之间的关系式计算.
B.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产;
C.电解时,阴极上氢离子放电,阳极上碘离子放电;
D.根据电解方程式结合碘酸钾和转移电子之间的关系式计算.
解答:
解:A.根据电池反应式知,阳极上碘离子放电生成碘酸根离子,则阳极应该为惰性电极石墨,阴极为铁,故A错误;
B.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产碘酸钾,故B错误;
C.电解过程中,I-向阴极移动,在阳极上碘离子放电生成KIO3,电极反应为I--6e-+3H2O=IO3-+6H+,故C错误;
D.根据反应:KI+3H2O
KIO3+3H2↑,每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体,故D正确;
故选:D.
B.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产碘酸钾,故B错误;
C.电解过程中,I-向阴极移动,在阳极上碘离子放电生成KIO3,电极反应为I--6e-+3H2O=IO3-+6H+,故C错误;
D.根据反应:KI+3H2O
| 电解 |
故选:D.
点评:本题考查了电解原理,根据电池反应式判断阴阳极材料、电极反应,并结合盐的性质分析解答,难度中等.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
下列最简式中,没有相对分子质量也可以确定分子式的是( )
| A、CH2O |
| B、CH2 |
| C、CH |
| D、C2H5 |
有两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀溶液.电解时当甲池电极析出1.6g Cu时,乙池电极析出0.54g金属,则乙池的溶质可能是( )
| A、NaNO3 |
| B、Mg(NO3)2 |
| C、Al(NO3)3 |
| D、Cu(NO3)2 |
“低碳生活”已成为热门话题.下列环境问题与CO2的排放有关的是( )
| A、酸雨 | B、白色污染 |
| C、臭氧层破坏 | D、温室效应 |
 的有机物,在PMR谱上观察峰给出的强度之比为
的有机物,在PMR谱上观察峰给出的强度之比为