题目内容
常温下,用 0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )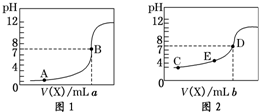

| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸溶液的初始pH确定盐酸滴定曲线;
B、溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性分析;
C、根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度;
D、甲基橙PH变色范围3.1-4.4,酸性中指示终点,氢氧化钠和盐酸反应恰好中性,氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,所以滴定过程用甲基橙作为指示剂,颜色变化为红色变化为黄色.
B、溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性分析;
C、根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度;
D、甲基橙PH变色范围3.1-4.4,酸性中指示终点,氢氧化钠和盐酸反应恰好中性,氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,所以滴定过程用甲基橙作为指示剂,颜色变化为红色变化为黄色.
解答:
解:A、如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,故A错误;
B、c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,盐酸溶液中滴入20.ooml氢氧化钠溶液恰好完全中和,醋酸溶液中滴入的氢氧化钠溶液小于20.00ml,a>b,故B错误;
C、根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D、甲基橙PH变色范围3.1-4.4,酸性中指示终点,氢氧化钠和盐酸反应恰好中性,氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,所以滴定过程用甲基橙作为指示剂,颜色变化为红色变化为黄色,故D错误;
故选C.
B、c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,盐酸溶液中滴入20.ooml氢氧化钠溶液恰好完全中和,醋酸溶液中滴入的氢氧化钠溶液小于20.00ml,a>b,故B错误;
C、根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D、甲基橙PH变色范围3.1-4.4,酸性中指示终点,氢氧化钠和盐酸反应恰好中性,氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,所以滴定过程用甲基橙作为指示剂,颜色变化为红色变化为黄色,故D错误;
故选C.
点评:本题考查了图象分析,酸碱反应定量关系和溶液酸碱性的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、在干冰晶体中,与一个CO2分子相邻且等距离的CO2分子共有12个 |
| B、在SiO2晶体中,若含有1molSi原子,则Si-O键数为4NA |
| C、在金刚石晶体中,一个碳原子被12个六元碳环所共用,一个C-C键最多可形成6个六元环,一个六元环实际拥有一个碳原子 |
| D、mg石墨中,正六边形数目为m NA/24,每个环拥有碳原子数与C-C键数之比为2:3 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )
| A、电池的电解质溶液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池放电过程中,溶液中的OH-向负极移动 |
| D、电池放电与充电过程发生的化学反应是可逆反应 |
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A、溶液的质量变化:甲减小乙增大 |
| B、溶液pH变化:甲减小乙增大 |
| C、相同条件下产生气体的体积:V甲=V乙 |
| D、电极反应式:甲中阴极为Cu2++2e-═Cu,乙中负极为Mg-2e-═Mg2+ |
下列叙述正确的是( )
| A、用热的纯溶液清洗油污的原理可表示为:CO3 2-+H2O?HCO3-+OH- |
| B、0.1 mol?L-1的NaHCO3溶液中:K+、Al 3+、Fe3+、NO3- 可大量存在 |
| C、室温下,某溶液中只含有Al 3+、K+、NO3-、SO4 2-,则该溶液由水电离出的c(H+ )=10-13 mol?L-1 |
| D、可以用加热蒸干并充分灼烧的方法得到CuCl2溶液的溶质固体 |
在2L容积不变的容器中,发生N2+3H2?2NH3的反应.现通入4mol H2和4mol N2,10s内用H2表示的反应速率为0.12mol/(L?s),则10s内N2的化学反应速率是( )
| A、0.12mol/(L.s) |
| B、0.36 mol/(L.s) |
| C、0.04 mol/(L.s) |
| D、0.24 mol/(L.s) |
若Y为短周期元素,Y原子最外层的P能级上的未成对电子数与s能级电子数相等.下列与Y有关的描述中正确的是( )
| A、Y一定是非金属元素 |
| B、Y元素与氢元素形成的化合物中只含有极性共价键 |
| C、Y的氧化物都能与NaOH反应 |
| D、Y的最高价氧化物对应的水化物都是H2RO3 |
 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.