题目内容
常温下,在20mL0.1mol?L-1Na2CO3溶液中逐渐滴入0.1mol?L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:碳酸钠的物质的量为:0.1mol/L×0.02L=0.002mol,盐酸的物质的量=0.1mol/L×0.04L=0.004mol,当二者反应时,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,碳酸氢钠和盐酸反应生成氯化钠和二氧化碳,根据二者的物质的量可知,二者恰好反应生成氯化钠、二氧化碳和水,
A.反应后的溶液中含有部分二氧化碳,溶液为弱酸性;
B.加入10mL盐酸时,恰好反应生成碳酸氢钠,碳酸氢根离子浓度大于碳酸根离子;
C.根据碳酸钠溶液中的质子守恒进行判断;
D.加入盐酸后,溶液中存在氯离子,电荷守恒中必须含有氯离子.
A.反应后的溶液中含有部分二氧化碳,溶液为弱酸性;
B.加入10mL盐酸时,恰好反应生成碳酸氢钠,碳酸氢根离子浓度大于碳酸根离子;
C.根据碳酸钠溶液中的质子守恒进行判断;
D.加入盐酸后,溶液中存在氯离子,电荷守恒中必须含有氯离子.
解答:
解:A.完全反应后,部分二氧化碳溶于水,导致溶液呈弱酸性,故A错误;
B.当盐酸加入20mL时,二者恰好反应生成碳酸氢钠,碳酸氢根离子水解导致溶液中NaHCO3的物质的量小于0.002mol,故B错误;
C.碳酸钠溶液中存在质子守恒,根据质子守恒得:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-),故C正确;
D.加入20mL盐酸后,溶液中含有了氯离子,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故D错误;
故选C.
B.当盐酸加入20mL时,二者恰好反应生成碳酸氢钠,碳酸氢根离子水解导致溶液中NaHCO3的物质的量小于0.002mol,故B错误;
C.碳酸钠溶液中存在质子守恒,根据质子守恒得:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-),故C正确;
D.加入20mL盐酸后,溶液中含有了氯离子,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故D错误;
故选C.
点评:本题考查了离子浓度大小的判断,题目难度中等,明确反应过程及混合液中的溶质组成为解本题关键,结合电荷守恒和物料守恒判断溶液中各离子浓度大小.

练习册系列答案
相关题目
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol?L-1的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现.若用过量的CO在高温下还原原混合物,固体质量减少为( )
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
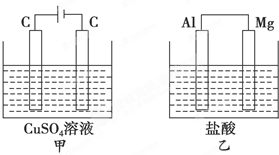 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A、溶液的质量变化:甲减小乙增大 |
| B、溶液pH变化:甲减小乙增大 |
| C、相同条件下产生气体的体积:V甲=V乙 |
| D、电极反应式:甲中阴极为Cu2++2e-═Cu,乙中负极为Mg-2e-═Mg2+ |
 以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O
以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O| 通电 |
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、不锈钢电极上生成O2,惰性电极上得到H2 |
| C、惰性电极发生的电极反应为2H2O-4e-═4H++O2↑ |
| D、不锈钢应连接直流电源的正极 |
下列叙述正确的是( )
| A、用热的纯溶液清洗油污的原理可表示为:CO3 2-+H2O?HCO3-+OH- |
| B、0.1 mol?L-1的NaHCO3溶液中:K+、Al 3+、Fe3+、NO3- 可大量存在 |
| C、室温下,某溶液中只含有Al 3+、K+、NO3-、SO4 2-,则该溶液由水电离出的c(H+ )=10-13 mol?L-1 |
| D、可以用加热蒸干并充分灼烧的方法得到CuCl2溶液的溶质固体 |
下列生产、生活、实验中的行为,符合安全要求的是( )
| A、进入煤矿井下作业,戴上安全帽,用帽上的矿灯照明 |
| B、节日期间,可以在热闹繁华的商场里燃放烟花爆竹,欢庆节日 |
| C、点燃打火机,可以检验液化气钢瓶口是否漏气 |
| D、实验室里,可以将水倒入浓硫酸及时用玻璃棒搅拌,配制稀硫酸 |
 2011年西安世园会期间对大量盆栽鲜花施用了S-诱抗素剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
2011年西安世园会期间对大量盆栽鲜花施用了S-诱抗素剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、含有碳碳双键、羧基、羟基三种官能团 |
| B、1mol该物质在催化剂加热条件下最多可与4molH2发生加成反应 |
| C、1mol该有机物与足量的溴水反应能消耗4molBr2 |
| D、该分子中所有碳原子可能位于同一平面上 |
已知5%氨水的密度为0.98g/cm,25%氨水的密度为0.91g/cm,若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )
| A、等于15% | B、大于15% |
| C、小于15% | D、无法估计 |
 牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:
牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究: